CAR T-терапия обеспечила пациентам с лейкозом десятилетнюю ремиссию
Результаты десятилетнего наблюдения за CAR T-клетками в организме двух реципиентов опубликованы в Nature. Оба пациента участвовали в фазе 1 клинических испытаний CAR T-терапии хронического лимфоцитарного лейкоза в 2010 году и в том же году достигли полной ремиссии. Спустя десять лет CAR T-клетки все еще детектировались в крови пациентов и обладали противораковой активностью.
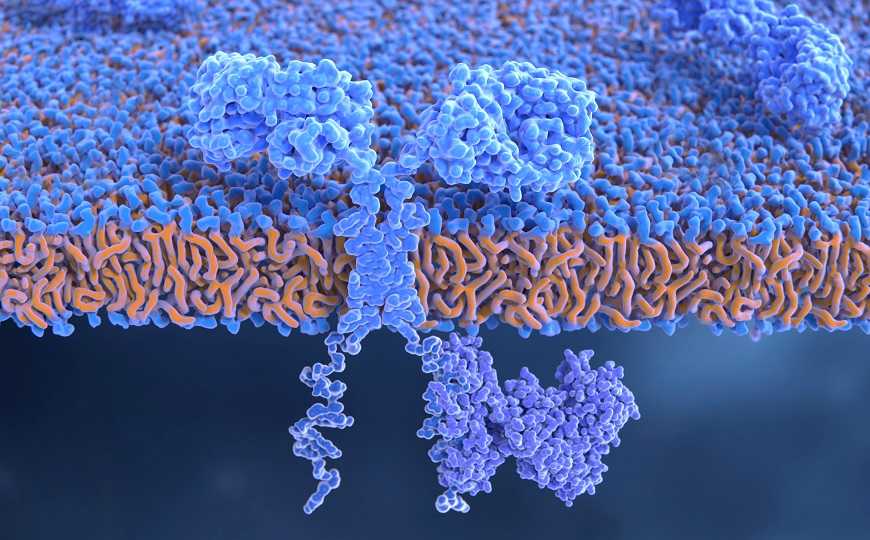
CAR T-клетки — это модифицированные T-лимфоциты (как правило, полученные от пациента), геном которых отредактирован так, чтобы обеспечить экспрессию химерного антигенного рецептора (CAR). Этот рецептор специфичен к маркерам раковых клеток. Хронический лимфоцитарный лейкоз развивается из-за чрезмерной пролиферации клеток, произошедших от CD19+ B-лимфоцитов. Клинические испытания анти-CD19 CAR T-терапии хронического лимфоцитарного лейкоза начались в 2010 году. У двух пациентов, участвовавших в фазе 1 клинических испытаний, была достигнута полная ремиссия. Ученые в течение десяти лет наблюдали за изменениями в популяции CAR T-клеток у этих пациентов. Результаты их наблюдений опубликованы в Nature.
Анти-CD19 CAR T-клетки достигли максимальной численности через три дня после инъекции CAR T-клеток у первого пациента и через 31 день у второго пациента (он получил в 78 раз меньшую дозу CAR T-клеток). Спустя десять лет после инъекции CAR T-клетки все еще детектировались проточной цитометрией и составляли 0,8% и 0,1% от всех T-лимфоцитов у первого и второго пациента соответственно. CD19+ B-лимфоциты и клетки хронического лимфоцитарного лейкоза (CLL-клетки) не детектировались вовсе или составляли менее 1% всех лимфоцитов спустя три года после инъекции.
Анализ репертуара T-клеточных рецепторов оказался возможным лишь для ранних образцов из-за требований к количеству тестируемых клеток. Он показал, что на протяжении первых двух лет после терапии у обоих пациентов происходил клональный сдвиг, однако с разной интенсивностью. Сайты интеграции CAR в геном были представлены большим числом вариантов (7930 и 3406) у обоих пациентов.
У первого пациента CD8+ клетки составляли 29,3% всех CAR T-клеток через 1,8 месяца после инъекции. Доля CD4+ клеток постепенно увеличивалась, пока они не составили 97,5% всех CAR T-клеток спустя 1,4 года и более 99,6% спустя 3,4 года. Такое количество сохранилось до конца наблюдений. У второго пациента также наблюдалась тенденция к увеличению доли CD4+ CAR T-клеток до 97,6% спустя 7,2 года после инъекции.
Наибольшие отличия в популяции CAR T-клеток у двух пациентов наблюдались в количестве CD4- CD8- клеток. Эта популяция была представлена гамма дельта CAR T-клетками и составляла 3,2% у первого пациента через 1,8 месяца после инъекции. У второго пациента доля гамма дельта клеток достигала 33,4% всей популяции CAR T-клеток через 2,5 месяца и 46,5% популяции через 1,6 года, и лишь после этого их количество пошло на спад, достигнув 0,5% через 7,2 лет.
CD4+ CAR T-клетки, составлявшие в итоге большую часть популяции CAR T-клеток, экспрессировали ген Ki67, соответствующий пролиферативному фенотипу. Секвенирование единичных клеток показало, что, по сравнению с обычными T-клетками, клональный репертуар CAR T-клеток гораздо беднее. При этом CAR T-клетки чаще находились в фазах S, G2 или M (30% против 7% у обычных T-клеток), что соответствует их большей пролиферативной активности.
CAR T-клетки, извлеченные из крови первого пациента спустя 9,3 года, все еще обладали CD19-узнающей и цитотоксической активностью. Авторы продемонстрировали это при стимуляции CAR T-клеток клеточной линией K562, экспрессирующей рецептор CD19.
Таким образом, вероятнее всего, долгосрочный эффект CAR T-терапии поддерживается популяцией CD4+ CAR T-клеток, которые остаются активными в течение десяти лет после попадания в кровь пациента.
Источник
Melenhorst J.J., et al. Decade-long leukaemia remissions with persistence of CD4+ CAR T cells. // Nature, 2022; DOI: 10.1038/s41586-021-04390-6








 Меню
Меню





 Все темы
Все темы



 0
0