CRISPR-система активирует экспрессию молчащих генов у Streptomyces
Ученые из США запустили синтез жадомицина в бактериях рода Streptomyces. Для этого они применили систему CRISPRa, которая способствует активации молчащих генов. Это первый случай применения CRISPRa в стрептомицетах — важных источниках биотехнологических субстанций.
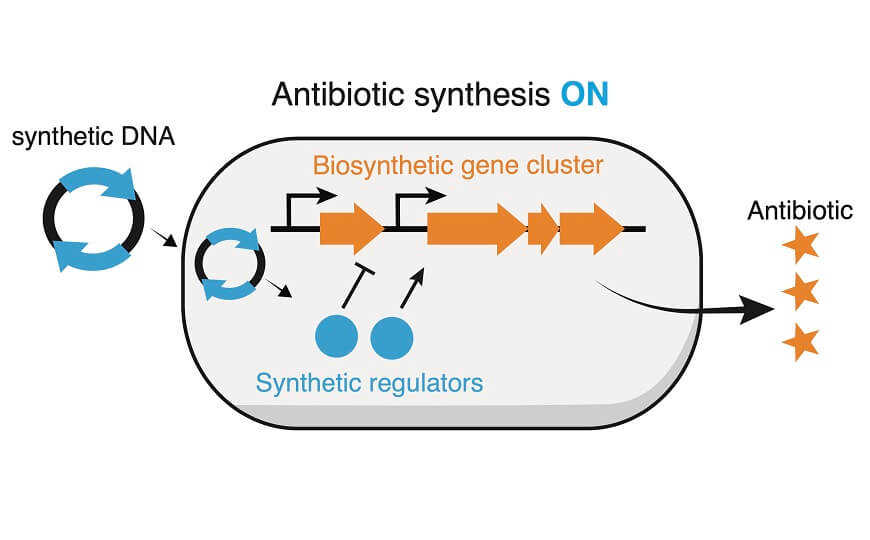
Рост устойчивости бактерий к антибиотикам — угроза глобальному здравоохранению. Один из путей ее устранения — поиск новых антибиотиков. Но со временем эта задача становится все сложнее. Важный источник новых противомикробных веществ — бактерии рода Streptomyces, обладающих множеством биосинтетических кластеров (BGC). Однако работа с ними затруднена из-за того, что многие BGC молчат в лабораторных условиях. Одним из возможных способов решения этой проблемы является искусственная активация BGC. В этом исследователям из Университета Райса (США) помогла система CRISPR, которая обладает способностью изменять экспрессию генов.
В состав системы входит мутантный белок dCas9 без нуклеазной активности. Этот белок может препятствовать транскрипции определенного гена, физически перекрывая путь РНК-полимеразе (CRISPRi). Также dCas9 может быть сшит с различными активирующими доменами. В таком случае он способствует привлечению РНК-полимеразы и экспрессии гена (CRISPRa).
Особенность этих методов заключается в специфичности протоколов для каждого организма. Авторы работы впервые оптимизировали CRISPRa и CRISPRi для бактерий рода Streptomyces. Они выбрали вид S. venezuelae — важный биотехнологический объект со множеством инактивированных BGC. Для количественной оценки систем CRIPSRi и CRIPSRa ученые использовали ген красного флуоресцентного белка в качестве мишени.
Сначала авторы оптимизировали технологию CRISPRi. Среди интересующих их параметров была экспрессия компонентов системы, место взаимодействия гидовой РНК (гидРНК) с геном и то, на какую цепь ДНК гена будет нацелен CRISPRi (смысловую или антисмысловую). Ученые обнаружили, что экспрессия dCas9 почти не влияла на эффективность CRISPRi, в то время как усиление синтеза гидРНК приводило к большему подавлению синтеза репортерного гена. Также исследователи выяснили, что инактивация гена наиболее эффективна, когда гидРНК нацелена на начало гена и взаимодействует с антисмысловой цепью.
Затем ученые приступили к решению более сложной задачи — они впервые создали систему CRISPRa для S. venezuelae. Авторы проверили три возможных домена активации. Первым доменом была субъединица ⍵, которая участвует в стабилизации РНК-полимеразы. Вторым возможным активатором выступал N-концевой домен субъединицы α (αNTD), который участвует в инициации транскрипции. В дополнение к этим активационным доменам ученые использовали транскрипционный фактор А, который взаимодействует с РНК-полимеразой (RbpA).
Из трех активационных доменов эффективно сработал только αNTD. Ученые предполагают, что RbpA и ⍵, в отличие от αNTD, не справляются из-за наличия конкуренции с эндогенными белками. Они также показали, что при выборе PAM и TSS необходимо учитывать спиральную структуру ДНК.
Наконец, ученые продемонстрировали практическую ценность своих разработок. Для этого они сосредоточились на активации синтеза жадомицина. Этот метаболический путь требует 23 ферментов, экспрессия которых находится под контролем сложной регуляторной сети из семи белков. В стандартных лабораторных условиях BGC жадомицина не активен.
Авторы сконцентрировались на двух наиболее популярных регуляторных белках: JadR1 (активатор) и JadR2 (репрессор). Основываясь на литературных данных, они предложили блокировать синтез JadR2 с помощью CRIPSRi. По предположению исследователей, это должно было привести к активации BGC. Аналогично, ученые попытались активировать экспрессию JadR1 и, таким образом, запустить биосинтетический путь. Обе стратегии успешно сработали и привели к активации BGC.
Исследователи отмечают, что в своей работе они сконцентрировались только на одном BGC. “В настоящее время предсказано, что каждый штамм Streptomyces способен продуцировать в среднем до 40 различных молекул, включая антибиотики”, — утверждает Джеймс Чаппел, один из авторов работы. Он планирует использовать новую технологию для активации синтеза каждой из этих молекул.
Источники:
Andrea Ameruoso, et al. Activating natural product synthesis using CRISPR interference and activation systems in Streptomyces. // Nucleic Acids Research. 2022. DOI: 10.1093/nar/gkac556
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0








