Диагностика SARS-CoV-2 в России: уроки первого года
25–27 мая 2021 года в МВЦ «Крокус-Экспо» прошел I Всероссийский конгресс с международным участием по фундаментальным проблемам лабораторной диагностики «Академия лабораторной медицины: новейшие достижения». В первый день работы конгресса докладчики рассказали о российских вариантах SARS-CoV-2 и российском наборе для их выявления, о том, как организовать скрининг сотрудников на предприятии. Один из докладов был посвящен борьбе с коронавирусом в Германии.

Заместитель руководителя ФМБА Игорь Борисевич приветствовал участников от имени ФМБА и лично от руководителя агентства Вероники Скворцовой.
На пленарном заседании Татьяна Вавилова, заведующая кафедрой лабораторной медицины и генетики НМИЦ имени В.А. Алмазова и главный внештатный специалист по клинической лабораторной диагностике Минздрава России, прочитала доклад «Микровезикуляция клеток крови и формирование экстрацеллюлярных сетей как механизм активации свертывания».
Герман Шипулин, заместитель генерального директора по научно-производственной деятельности Центра стратегического планирования ФМБА России, выступил с докладом «Молекулярная диагностика в эпоху COVID-19», в котором ответил на вопрос, можно ли разработать тест-систему за четыре дня. Докладчик рассмотрел все этапы создания тестов, от разработки и синтеза праймеров и зондов до масштабирования производства, и подчеркнул, что минимальные сроки, которые для этого необходимы, — три недели. Герман Шипулин также привел реальные примеры разработки тест-систем, детектирующих SARS-CoV-2, в России и за рубежом.
С докладом «От диагностики молекулярной сенсибилизации аллергии до разработки терапевтических и профилактических вакцин» выступил Муса Хаитов, член-корреспондент РАН, директор Института иммунологии ФМБА России, главный внештатный специалист аллерголог-иммунолог ФМБА.
Андрей Буланов, главный специалист-трансфузиолог Департамента здравоохранения Москвы, рассказал о мониторинге системы свертывания крови при COVID-19». Завершил пленарное заседание докладом «Динамика иммунного ответа на SARS-CoV-2» Владимир Баклаушев, д.м.н., заместитель генерального директора по научной работе и медицинским технологиям ФНКЦ ФМБА России, главный внештатный специалист по клинической лабораторной диагностике ФМБА.
 Фото: Оксана Сорокина
Фото: Оксана Сорокина
После пленарного прошло секционное заседание «Молекулярная диагностика и эпидемиология COVID: уроки эпидемии».
Открыл заседание Георгий Базыкин (Сколковский институт науки и технологий, Институт проблем передачи информации им. А.А. Харкевича РАН) с докладом «Геномная эпидемиология SARS-CoV-2 в России».
Россия стабильно занимает пятое-шестое по числу зарегистрированных случаев COVID-19 среди стран мира. Основная причина, по которой важно исследовать генетическое разнообразие вирусов, циркулирующих в России и в мире, — поиск вариантов с измененными свойствами. Измениться могут трансмиссивность, способность уходить от антител или характеристики течения заболевания. Базыкин привел в качестве примера «британский» вариант, который, как уже доказано, обладает повышенной трансмиссивностью. Это важно знать для того, чтобы строить эпидемиологические прогнозы.Возможности эволюционировать для вируса пропорциональна размеру вспышки заболеваемости.
Глобальный репозиторий геномных данных коронавируса GISAID содержит 1,8 млн последовательностей SARS-CoV-2. Много данных в репозиторий приходит из Великобритании. Россия выложила всего 3,5 тысячи последовательностей (сейчас уже более 4 тысяч. — PCR.NEWS); мы секвенируем меньше 0,1% всех случаев. Разнообразие коронавирусов в России остается практически неисследованным.
Далее докладчик рассказал о работе, которую выполнили исследователи из ИППИ и Сколтеха на открытых данных GISAID при поддержке консорциума CoRGI — Коронавирусная российская генетическая инициатива (подробнее об этой работе на PCR.NEWS). Он перечислил наиболее часто встречающиеся мутации в геноме коронавируса, в том числе в S-белке. Варианты с этими мутациями возникли еще прошлым летом; постепенно их частота растет. Это необязательно значит, что варианты более заразны. Однако уже сейчас видно, как распространяются предковый вариант B.1.1, «российские» B.1.1.317 и B.1.1.397+, а также «британский» B.1.1.7.
Сравнение двух «российских» вариантов показало, что вариант с бóльшим числом мутаций вытесняет вариант с меньшим числом. Вероятно, какие-то из этих мутаций повышают трансмиссивность. Тем не менее, скорость распространения «российских» вариантов не так велика, поэтому их вытесняет «британский» вариант. Не так давно внимание исследователей привлекли новые варианты, B.1.1.v1 и B.1.1.v2, частота которых устойчиво растет.
В конце доклада Базыкин подчеркнул, что нужна общая мультирегиональная система для систематического мониторинга вариантов.

Продолжил секционное заседание Михаил Иванов, начальник лаборатории ПЦР «Вектор-Бест» из Новосибирска, с докладом «Опыт тотального скрининга сотрудников промышленного предприятия на РНК SARS-CoV-2 в условиях эпидемии».
Первый случай заболевания COVID-19 у сотрудника «Вектор-Бест» выявили 24 апреля 2020 года. Все контактировавшие с ним сотрудники были протестированы и изолированы, однако случай оказался единичным.
С 28 апреля 2020 года начался организованный скрининг всех сотрудников. Сначала его производительность была низкой из-за неуверенности в результате и незнания особенностей эпидемии. На тот момент не были известны даже летальность и возможность передачи вируса бессимптомными больными.
Был организован пункт забора образцов, однако это создавало скопления людей. Тогда акцент сделали на самозабор, вопреки рекомендациям. От самозабора из носоглотки пришлось отказаться: «Технически проблематично. Люди жаловались, что к ним лезут зондами в мозг», — прокомментировал докладчик. Пришлось ограничиться самозабором из ротоглотки.
Набор ПЦР создавался предприятием и регистрировался практически в отсутствии клинических проб, поэтому не было полной уверенности, что система работает. Каждый положительный результат подтверждали перезабором. В течение семи недель выявили девять инфицированных сотрудников, после этого число заболевших непрерывно росло.
Михаил Иванов рассказал о выводах, сделанных в результате скрининга. Мутаций, влияющих на результат, не обнаружили, то есть популяция вируса в то время была гомогенной. Часто РНК выявлялась до проявления симптомов или при незначительных симптомах. После клинического выздоровления РНК выявлялась долгое время. Чаще всего инфекция приходила извне, а не от других сотрудников «Вектор-Бест». Результаты официальных лабораторий зачастую отличались от собственных результатов «Вектор-Бест».
В дальнейшем процесс удалось автоматизировать с помощью разработанной на предприятии станции RbMag. Для повышения производительности применяли минипулирование образцов от четырех сотрудников. Иванов подчеркнул, что методика была нестандартизированной, однако позволяла осуществлять скрининг с высокой частотой. На момент доклада около 40% сотрудников переболели; при этом скрининг пропустил всего троих. Выявлено два случая повторного заражения, один — «британским» вариантом.
Далее выступил Андрей Васин, и.о. директора Института биомедицинских систем и биотехнологий Санкт-Петербургского политехнического университета Петра Великого, заведующий отделом молекулярной биологии вирусов НИИ гриппа им. А.А. Смородинцева Минздрава, с докладом «Новые варианты SARS-CoV-2 в России: опыт российского консорциума по секвенированию геномов коронавирусов».
Докладчик обратил внимание, что полногеномных сиквенсов SARS-CoV-2 на GISAID уже около 1,8 миллиона, а вируса гриппа (самого хорошо изученного вируса до пандемии) — около 300 тысяч.
Полногеномное секвенирование нужно для предотвращения распространения, расследования первичных вспышек и отслеживания контактов. Но если момент был упущен, то основной задачей становится смягчение последствий, например, мониторинг новых вариантов.
Какое количество вирусов нужно секвенировать, чтобы выявлять новые варианты? В Великобритании секвенируют около 7,5% положительных случаев, в Исландии — около 67%. В России этот процент катастрофически мал.
Васин также рассказал о вариантах, характерных для России: предковый вариант B.1.1, эндемические B.1.1.317 и B.1.1.397+ и мировые, такие как «британский» вариант. Кроме B.1.1.317 и B.1.1.397+, Институт гриппа выявил минорные российские линии. Для первой, B.1.1.141, характерны три мутации в S-белке. Первые образцы были выявлены летом 2020 года в Новосибирской области и в Приморском крае. Линию условно назвали «латвийской». Пока неясно, представляет ли эта линия интерес для России, также неизвестна функция мутаций.
Линия K.2 имеет две мутации в S-белке, первые образцы были выявлены в июле-августе 2020 года в Приморском крае. В GISAID всего 25 сиквенсов генома этой линии. Линия считается «затухшей», но точно сказать нельзя из-за малого числа образцов.
Еще одна линия с тремя мутациями в S-белке обнаруживалась главным образом в Москве и Центральном федеральном округе. Одна из этих мутаций может увеличивать связывание с рецептором и позволять варианту обходить действие вакцин.
Наиболее интересная с точки зрения вирусологии линия — AT.1, так называемый северо-западный вариант. Первые образцы были обнаружены в феврале-марте 2021 года в Псковской области и Санкт-Петербурге, два генома — в Хельсинки. В S-белке нашли несколько мутаций, делеции и инсерцию. Таких вставок раньше описано не было, пока неясно, влияет ли она на свойства вируса.
Докладчик подчеркнул, что за распространением этих линий необходимо пристально следить. Только сотрудничество организаций позволит России осуществлять масштабные полногеномные исследования.
С докладом «COVID-19: Epidemiological update and response in Germany» выступила Инесса Маркус, эпидемиолог из Института Роберта Коха (Германия).
Она описала трехуровневую структуру системы здравоохранения Германии. На федеральном уровне выпускаются рекомендации и осуществляются международная коммуникация. На уровне 16 субъектов — федеральных земель — тоже выпускаются рекомендации и осуществляется поддержка локальных должностных лиц, которые, в свою очередь, первыми отвечают на угрозы общественному здоровью.
Вторая волна пандемии в Германии была достаточно сильной; правительство ответило усилением карантинных мер. Третья волна была вызвана, скорее всего, появлением новых вариантов, вызывающих опасение.
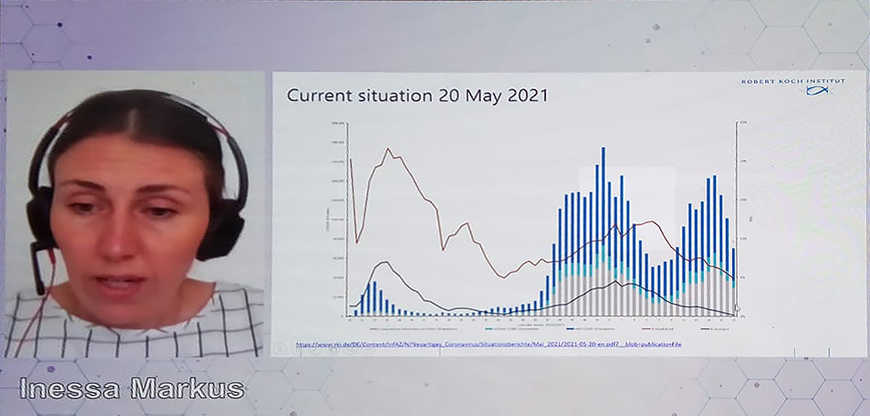
На 20 мая 2021 года в Германии умерло 86 902 человека (2,4% всех заразившихся). Каждые семь дней появляется 68 новых случаев на 100 000 жителей, 87% всех положительных случаев вызваны «британским» вариантом. Карантинные меры в федеральных землях зависят от эпидемиологической ситуации. Кроме дистанции и ношения СИЗ, правительство по мере необходимости вводит комендантский час, закрывает магазины и рестораны, школы. Запретов на передвижение нет, но путешествовать не рекомендуется.
Полным ходом идет вакцинация. На 20 мая частично привиты 39% населения, полностью — 12,5%. Также отслеживают контакты зараженных и постоянно следят за загруженностью реанимационных отделений.
Институт Роберта Коха постоянно наблюдает за ситуацией, в том числе международной, и оказывает поддержку правительству.
Екатерина Алексеева (Медико-генетический научный центр имени академика Н.П. Бочкова) описала случай пациента, который долгое время болеет COVID-19 на фоне иммуносупрессивной терапии. Пациент болен неходжкинской лимфомой, из-за терапии ритуксимабом B-клеточный ответ у него полностью отсутствовал. (Подробности этого случая на PCR.NEWS.)
Первый положительный ПЦР-тест у пациента был получен в апреле 2020 года. После этого вирус не определялся, но пациент болел пневмонией с типичной для коронавируса картиной. Через шесть месяцев положительные ПЦР-тесты возобновились. После этого — затишье, а через пять месяцев, в январе, снова определялся коронавирус.
У исследователей имелись сиквенсы коронавируса из первого и второго периодов. С помощью филогенетического анализа удалось подтвердить источник заражения и то, что второй период болезни был результатом не повторной, а изначальной инфекции.
За 11 месяцев вирусная популяция в организме эволюционировала. Выявили 42 замены, которые появлялись с высокой частотой, из них 26 — несинонимичные. Мутации были достаточно равномерно распределены по геному коронавируса. Большая их часть появилась в первые пять месяцев инфекции.
Далее докладчица описала стратегии, которые обычно использует вирус для ухода от T-клеточного иммунного ответа: нарушение сайтов, по которым иммунопротеасома нарезает белок, изменение аминокислот, необходимых для крепления к HLA, и нарушение иммуногенности комплекса HLA-пептид для T-клеточного рецептора.
При анализе вирусов пациента выявили мутации, которые мешают прикреплению к HLA. Были обнаружены также мутации, которые способствуют прикреплению к HLA, но их было меньше. Полученные результаты объясняют тот факт, что у пациента не было обнаружено T-клеточного иммунного ответа. Основной адаптивный эффект мутации имели для аллеля HLA-A*01:01.
Юлия Савочкина (ЦСП ФМБА России), прочитала доклад «Разработка и опыт применения наборов реагентов для выявления РНК SARS-CoV-2 на основе методов ПЦР и LAMP».
К разработке ПЦР-теста на коронавирус рабочая группа ЦСП приступила еще в январе 2020 года. В качестве мишени был выбран участок РНК-зависимой РНК-полимеразы. Тест-систему закончили всего за несколько недель.
Созданный группой набор реагентов «АмплиТест SARS-CoV-2» выявляет РНК коронавируса в концентрации 1*103 геномных эквивалентов на миллилитр. Тест-систему проверили на реальных образцах в Берлине (в России на тот момент случаев заражения выявлено не было).
Не наблюдалось перекрестных реакций с другими коронавирусами и с бактериями, заражающими верхние и нижние дыхательные пути. В качестве внутреннего контроля в набор включена искусственно синтезированная РНК в оболочке фага.
Первые клинические испытания провели на РНК коронавируса, выделенной из мазков первых трех российских пациентов. В ходе КИ «АмплиТест SARS-CoV-2» сравнили с набором реагентов «РеалБест РНК SARS-CoV-2»; результаты полностью совпали.
Докладчица рассказала, что исследователи постоянно следят за появлением новых мутаций в последовательности праймеров и зондов. Пока такая замена была всего одна, и она не мешала амплификации.
Развитие тест-систем идет по пути сокращения времени, необходимого для анализа. Для этого чаще всего используют метод петлевой изотермической амплификации (LAMP). С помощью набора реагентов «АмплиТест SARS-CoV-2 LAMP» результат можно получить за несколько минут. Его особенность — это наличие внутреннего контрольного образца.
Юлия Савочкина продолжила секционное заседание докладом «Выявление мутаций в гене S вируса SARS-CoV-2, характерных для генетических линий особого эпидемиологического значения B.1.1.7, B.1.351 и P.1, методом ПЦР: разработка теста и применение его в ходе эпидемиологического мониторинга».
Савочкина рассказала о наиболее эпидемиологически значимых вариантах SARS-CoV-2: «британском», «южноафриканском», «бразильском» и «индийском». Для S-белков этих вариантов характерны такие мутации, как N501Y, повышающая аффинность к рецептору ACE2, E484K, которая снижает эффективность вакцинации и повышает тоже аффинность к рецептору, P681H, вероятно, повышающая трансмиссивность.
Мутации выявляют в основном с помощью полногеномного секвенирования, это самый информативный метод. ПЦР используют для раннего выявления и мониторинга распространенности известных вариантов. Существуют зарубежные наборы на основе ПЦР в реальном времени, предназначенные для выявления вызывающих беспокойство вариантов. Теперь появляются и отечественные.
Достаточно быстро в ЦСП ФМБА России разработали набор «АмплиТест SARS-CoV-2 VOC v.1». Набор позволяет выявлять сочетание мутаций N501Y, P681H и 69-70del, характерное для генетической линии B.1.1.7, сочетание мутаций N501Y и E484K, характерное для линий B.1.351 и P.1, или каждую мутацию отдельно. Диагностические чувствительность и специфичность составили 100%, результаты соответствовали данным секвенирования. Идет разработка новых версий набора реагентов, которые смогут определять в том числе «индийские» варианты.
Завершил секционное заседание Игорь Абдрахманов, директор по производству ООО «Эвотэк-Мирай Геномикс», с докладом «Лучшие практики первого года применения новой технологии быстрой ПЦР-диагностики SARS-CoV-2».
Компания «Эвотэк-Мирай Геномикс» создала «портативную ПЦР-лабораторию в чемодане» для диагностики SARS-CoV-2 на основе метода изотермической амплификации. «Чемоданы» были особенно эффективны в отдаленных регионах, где нет лабораторий. Также портативные лаборатории используют в аэропортах. Идет работа над системой, которая позволит проводить реакции в автомобиле.
Портативные лаборатории пользуются большим спросом в Австрии, Нидерландах и Венесуэле. По словам Игоря Абдрахманова, вначале их перевозили частными самолетами.
Также в компании создали автоматические станции, которые позволят исключить ошибки лаборантов. Такая станция почти завершила государственную регистрацию в России; в Нидерландах и Японии она уже работает. В завершение докладчик пригласил всех лично ознакомиться с производством в Казани.


 Меню
Меню





 Все темы
Все темы




 0
0