Для запоминания мышам необходимы воспаление и разрывы ДНК в нейронах
Гиппокамп отвечает за хранение кратковременной памяти и за консолидацию информации. Международная группа ученых нашла новую популяцию нейронов в гиппокампе мышей, отвечающих за формировании контекстуальных воспоминаний. В таких нейронах после того или иного события возникают двухцепочечные разрывы ДНК, присутствие которых активирует рецептор врожденного иммунитета TLR9. У мышей, нокаутных по этому рецептору, нарушалось формирование контекстуальной памяти.

За хранение воспоминаний в мозге отвечают гиппокамп и кора головного мозга. Функция гиппокампа состоит в сохранении кратковременной памяти и в консолидации информации — переводе ее из кратковременной памяти в долговременную. В формировании и хранении воспоминаний задействованы разные популяции нейронов. Например, в гиппокампе, а также в кортексе и в амигдале есть энграммные нейроны, которые участвуют в формировании долговременной памяти. Для этих нейронов характерно кратковременное повреждение ДНК и экспрессия немедленно-ранних генов (immediate early genes, гены раннего ответа), таких как cFos и Egr1, которая регулируется транскрипционным фактором CREB. Теперь международная группа ученых выявила у мышей еще одну популяцию нейронов гиппокампа, которая ответственна за формирование воспоминаний.
Ученые рассматривали, какие изменения происходят в нейронах гиппокампа мышей после выработки условного рефлекса в связи со страхом (fear conditioning). Мышей помещали в специальную установку, где им позволяли освоиться, а потом давали короткий удар током. В норме через 24-48 часов после такого теста в нейронах можно зафиксировать экспрессию немедленно-ранних генов, которая говорит о формировании воспоминания, а при повторных тестах мыши, оказываясь в той же установке, замирают в страхе, помня об ударе током. Исследователи решили узнать, что происходит в нейронах через более длительный срок после такого теста.
Сначала ученые секвенировали РНК клеток гиппокампа мышей через 96 часов или 21 день после теста. Через 21 день в нейронах в основном экспрессировались гены, связанные с ресничками и внеклеточным матриксом, что было связано с формированием перинейрональной сети — структуры, которая окружает синапсы и регулирует синаптическую пластичность. А через 96 часов в основном менялась экспрессия генов, связанных с врожденным иммунным ответом на присутствие нуклеиновых кислот, а также с вырабтокой цитокинов. Среди этих генов наиболее выраженной была экспрессия рецептора TLR9, а также генов, которые участвуют в NF-κB сигналинге, запускающемся после активации этого рецептора.
TLR9 — толл-подобный рецептор, который преимущественно распознает CpG-островки в бактериальной или вирусной ДНК и активируется в ответ на инфекцию. Обычно он локализуется в эндосомах, что наблюдалось и в нейронах гиппокампа. Инфекции у мышей не было, и ученые заподозрили, что TLR9 в нейронах активировался в ответ на фрагменты митохондриальной ДНК, которые могут образовываться при стрессе. Однако изолированные из нейронов фрагменты дцДНК происходили из геномной ДНК, преимущественно из некодирующих регионов.
Эксперименты продолжили с нейронами региона гиппокампа CA1, которые участвуют в формировании и хранении контекстуальных воспоминаний (связанных с определенным контекстом). Действительно, после теста по обуславливанию страха в нейронах происходили двухцепочечные разрывы ДНК и запускалась их репарация. Участки ДНК, в которых выявлялся фосфогистон γH2AX (маркер двухцепочечных разрывов), сохранялись в течение 6-96 часов после теста, причем только в нейронах, но не в астроцитах или микроглии. Этот процесс сопровождался повреждением ядерной ламины, из-за чего фрагменты ДНК и фосфогистон выбрасывались в перинуклеарное пространство, причем в те его участки, где находился неактивный TLR9. В ответ на повреждение ДНК в таких нейронах также активировался белок 53BP1, участвующий в негомологичном соединении концов (NHEJ). При этом 53BP1, как и часть фосфогистонов и фрагментов ДНК, находились вблизи центромер — вероятно, они задействованы не только в поддержании геномной целостности делящих клеток, но и в формировании памяти.
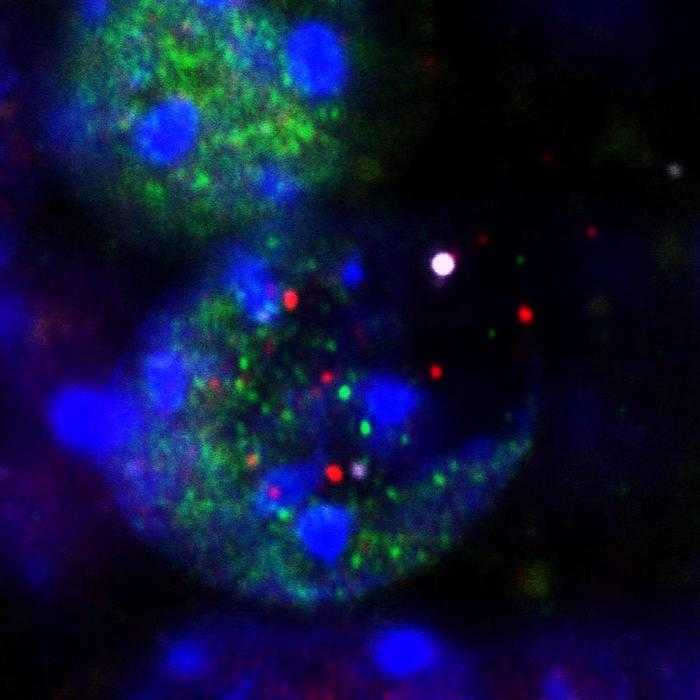 Из ядер нейронов, подвергающихся повреждению ДНК во время обучения, высвобождаются ДНК (белая точка в центре справа), гистоны (фиолетовые) и факторы транскрипции (красные и зеленые). Credit: Nature (2024). DOI:
10.1038/s41586-024-07220-7 |
Пресс-релиз
Из ядер нейронов, подвергающихся повреждению ДНК во время обучения, высвобождаются ДНК (белая точка в центре справа), гистоны (фиолетовые) и факторы транскрипции (красные и зеленые). Credit: Nature (2024). DOI:
10.1038/s41586-024-07220-7 |
Пресс-релиз
Оказалось, что те нейроны, в которых наблюдается длительное повреждение ДНК, не являются энграммными. В нейронах, где детектировался γH2AX, практически не были активны Fos, CREB и EGR1. При этом в них активировались сигнальные пути, связанные с воспалением, например, появлялся белок RELA — одна из субъединиц NF-κB. Эти особенности говорили о том, что исследователи имеют дело с новой популяцией нейронов.
Ученые захотели выяснить, вызывается ли воспаление в этих нейронах повреждением ДНК, которое происходит в ответ на обучение, или оно, напротив, необходимо для формирования воспоминаний. Для этого они получили мышей с нейронспецифическим нокаутом по Tlr9 (с помощью рекомбиназы Cre или короткой шпилечной РНК). У таких мышей нарушилась контекстуальная память: когда их помещали в установку, где ранее их били током, они не показывали страха. Аналогичным образом они не привыкали бояться звука, за которым через некоторое время следовал удар тока. Однако в другом тесте, когда мышей били током сразу после звукового сигнала — результаты нокаутных животных не отличались от контрольных, поскольку в этом тесте проверяется обучение, независимое от гиппокампа.
Чтобы подтвердить, что для формирования контекстуальной памяти требуется именно TLR9, а не другой сенсор внеядерной ДНК — cGAS, исследователи применили несколько препаратов, которые действуют тот или другой белок. Так, формирование контекстуальной памяти нарушал олигонуклеотид ODN2088, антагонист TLR9, но не малые молекулы RU-521 и H-151, ингибиторы пути cGAS–STING. На контекстуальную память также не влиял нокаут гена Sting1. Формирование контекстуальных воспоминаний нарушало подавление экспрессии ДНКазы II, которая расщепляет дцДНК на более короткие фрагменты, способные связываться с TLR9 и активировать его. А оверэкспрессия ДНКазы TREX1, которая ограничивает активацию пути cGAS–STING, опять же, не влияла на формирование контекстуальной памяти. Все это означало, что в этом процессе главную роль играет именно TLR9.
Секвенирование РНК отдельных ядер (snRNA-seq) показало, что нокдаун Tlr9 влияет на экспрессию генов после тестов по обуславливанию страха. У контрольных мышей дикого типа через 96 часов после таких тестов повышалась экспрессия генов, ассоциированных с формированием везикул, их транспортом и функцией, а также генов, которые связаны с выработкой интерлейкина-6, с фолдингом TLR9 и его активацией. У мышей с нокдауном Tlr9 их экспрессия не менялась.
Исследователи также показали, что активация TLR9 необходима для нормальной репарации ДНК после тестов на обуславливание страха, для цилиогенеза и для накопления перинейрональной сети. В этой серии экспериментов тесты проходили мыши с нокаутом по Rela и по Ifnar1 (кодирует рецептор интерферона). Через 24 часа после теста у всех мышей, включая контрольную группу, повысилось число нейронов с двухцепочечными разрывами ДНК. Однако у всех нокаутных мышей их было гораздо больше, в том числе у «наивных» мышей, которые не проходили тест по обуславливанию страха. У мышей с нокаутом по Tlr9 и по Rela белок 53BP1 не связывался ни с местами разрывов ДНК, ни с центромерами, что нарушало репарацию ДНК. У тех же мышей хуже формировались реснички и перинейрональная сеть.
Таким образом, исследователи нашли у мышей новую популяцию нейронов гиппокампа, для которой характерен воспалительный ответ, запускаемый через TLR9 в ответ на повреждение ДНК и которая участвует в формировании контекстуальных воспоминаний. TLR9 важен не только для иммунитета, но и для поддержания целостности генома, при его отсутствии нарушается работа системы репарации ДНК. Исследователи предположили, что TLR9, RELA и другие компоненты связанного с ними сигнального пути в будущем могут стать мишенями профилактических и терапевтических препаратов, предназначенных для сохранения когнитивных функций, в том числе при старении и нейродегенерации.
Мыши с расстройством аутистического спектра помнят раннее детство
Источник
Jovasevic, V. et al. Formation of memory assemblies through the DNA-sensing TLR9 pathway // Nature (2024). DOI: 10.1038/s41586-024-07220-7


 Меню
Меню





 Все темы
Все темы




 0
0








