Эффект хромосомной нестабильности в клетках рака зависит от иммунитета
Влияние хромосомной нестабильности в раковых клетках на образование метастазов связано с переключением сигнального пути cGAS-STING. Он активируется, но не вызывает интерферонового ответа, а участвует в ответе на стресс эндоплазматического ретикулума, что приводит к формированию прометастатического опухолевого окружения. Ингибиторы STING снижали влияние хромосомной нестабильности на образование метастазов у мышей.
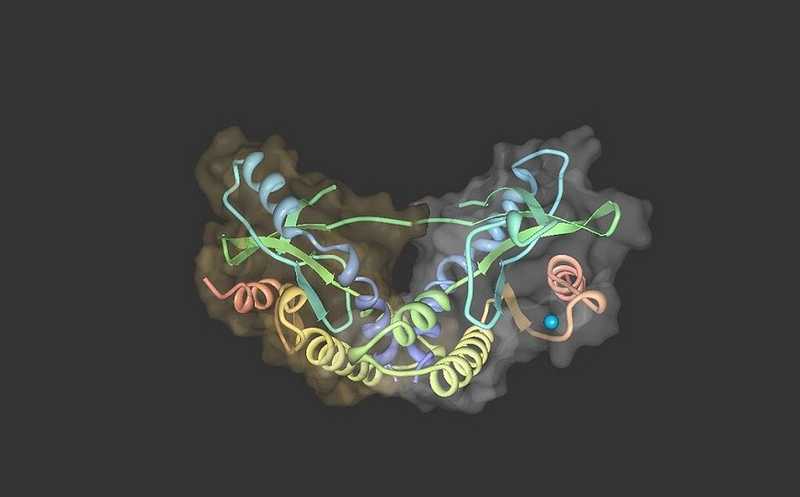
Стимулятор генов интерферона (STING), он же трансмембранный белок 173 (TMEM173) или MPYS/MITA/ERIS
Credit:
Wikimedia.org | CC BY-SA 3.0
Хромосомная нестабильность (CIN; нарушение расхождения хромосом при делении) в раковых клетках ассоциирована с устойчивостью к терапии, метастазами и подавлением иммунитета. Группа ученых из США и Великобритании ранее показала, что попадание хромосомной ДНК в цитоплазму при CIN вызывает хроническую активацию сигнального пути cGAS-STING — одного из компонентов врожденного иммунитета, активатора воспалительного ответа, — а это, в свою очередь, способствует метастазированию. В новой статье авторы выявляют зависимость данного процесса от иммунной системы и терапевтический потенциал ингибиторов STING.
В исследовании были использованы четыре линии раковых клеток: две линии трижды негативного рака молочной железы (4T1 и EO771.LMB), линия колоректальной аденокарциномы (CT26) и меланомы (B16F10). Во всех линиях наблюдалась активация cGAS-STING, зависимая от CIN.
Авторы вводили мышам клетки линии 4T1 с низким (CINlow) или высоким (CINhigh) уровнем CIN. Последние образовывали в 11 раз больше метастазов у мышей с нормальным иммунитетом, но всего на 10% больше — у животных с ослабленным иммунитетом. Нокаут Cgas или Sting1 значимо уменьшал число метастазов, но этот эффект у мышей с ослабленным иммунитетом также не наблюдался. Как ни парадоксально, для метастазирования, связанного с CIN и активацией cGAS-STING, требуется нормальный уровень иммунного ответа.
При этом анализ микроокружения имплантированных 4T1 клеток показал, что высокий уровень CIN ассоциирован с развитием микроокружения, способствующего метастазированию, которое характеризуется присутствием иммуноподавляющих макрофагов, гранулоцитных супрессорных клеток миелоидного происхождения (Gr-MDSCs) и нефункциональных Т-клеток. Напротив, в микроокружении CINlow клеток наблюдались активные воспалительные процессы.
Чтобы определить, каким образом cGAS-STING репрограммирует опухолевое микроокружение, авторы разработали алгоритм ContactTracing, который использует данные РНК секвенирования отдельных клеток для идентификации межклеточных взаимодействий по уровню экспрессии рецепторов и лигандов. Результаты анализа ContactTracing в основном соотносились с результатами изучения микроокружения — раковые клетки взаимодействовали с присутствующими вокруг клетками. При этом оказалось, что CIN- и STING-зависимые лиганды, участвующие во взаимодействиях, в основном ассоциированы с ответом на стресс эндоплазматического ретикулума (ЭР-стресс) — функциональную перегрузку аппарата секреции из-за накопления неправильно свернутых молекул белка.
Несмотря на то, что в CINhigh клетках идет постоянная cGAS-STING активация, она не сопровождается активной экспрессией интерферон-стимулирующих генов. Стимуляция ЭР-стресса при помощи туникамицина приводила к нормальному ответу в этих клетках. Однако нокаут Sting1 значительно снижал выраженность этого ответа. Нокаут рецепторов ЭР-стресса уменьшал число метастазов на мышиной модели.
Таким образом, STING-сигналинг в CINhigh раковых клетках сдвинут в сторону ответа на ЭР-стресс, вместо того чтобы, как в норме, стимулировать интерфероновый ответ.
С учетом полученных данных авторы предположили, что ингибирование STING может быть эффективной терапевтической стратегией для CINhigh раковых заболеваний. Действительно, введение ингибиторов STING C-176 или H-151 мышам, которым вводили раковые клетки линий 4T1, B16F10 или CT26, повышало выживаемость и снижало число метастазов, хоть и не так сильно, как нокаут Sting1. Введение ингибиторов мышам с нокаутом Sting1 эффекта не имело. Токсичности, ассоциированной с введением ингибиторов, не наблюдалось.
Исследователи также показали на клеточных культурах, что многократная последовательная стимуляция cGAS-STING в здоровых фибробластах снижает уровень активации интерферон-стимулированных генов с каждой последующей стимуляцией — чувствительность к стимуляции снижалась. Они предположили, что фенотип CINhigh клеток с низком содержанием STING (который характерен для метастатических раковых заболеваний) может быть объяснен хронической активацией STING через Cgas. Действительно, нокаут Cgas восстановил нормальные уровни STING.
Наконец, авторы проанализировали образцы раковых тканей, полученные от пациентов. Оказалось, что высокий уровень cGAS и низкий уровень STING ассоциированы с большим риском образования метастазов, а обратное соотношение — с более благоприятным прогнозом. Анализ микроокружения CINhigh и CINlow клеток на образцах от пациентов показал те же результаты, что и на мышиной модели.
Авторы подчеркивают перспективность ингибиторов STING для терапии различных типов рака при наблюдаемой хромосомной нестабильности. «В лекарства, которые активируют путь STING для борьбы с раком, были вложены миллионы долларов, и до сих пор в клинических испытаниях они не показали значительной противораковой эффективности, — говорит один из руководителей исследования, Сэмюэл Бахум из Мемориального онкологического центра Слоана-Кеттеринга. — В лаборатории эти препараты были многообещающими, но в одном исследовании с участием 47 пациентов только у двоих рак показал лишь частичный ответ; в другом исследовании суммарная доля ответов составила 10%. Таким образом, вопрос, лежащий в основе этого исследования, заключался в следующем: “Почему они не работают, несмотря на такие обещания в доклинических условиях?» Теперь можно предположить, что причина неэффективности агонистов STING — в десенсибилизации, и такие пациенты могут получить пользу от антагонистов STING.
Возрастная нейродегенерация связана с реакцией на мтДНК в цитоплазме
Источник
Li, J. et al. Non-cell-autonomous cancer progression from chromosomal instability // Nature, published August 23, 2023. DOI: 10.1038/s41586-023-06464-z
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0








