Эпигенетическую регуляцию при развитии 11 типов рака изучили на уровне единичных клеток
Ученые из США сопоставили профили эпигенома и транскриптома клеток 11 типов рака с помощью ATAC-seq и РНК-секвенирования на уровне единичных ядер. Возникновение рака было связано с эпигенетическими изменениями, затрагивающими пути, которые вовлечены в передачу сигналов TNF, развитие гипоксии и активность TP53, а метастазирование — с изменениями, влияющими на эстрогеновый ответ, апикальные клеточные соединения и процесс эпителиально-мезенхимального перехода.
Terekhanova N.V., et al. DOI: 10.1038/s41586-023-06682-5
Изменения в доступности хроматина и последующее взаимодействие с транскрипционным аппаратом играют важную, но не до конца понятную роль в возникновении, прогрессировании и метастазировании рака. Возможно, эпигенетические факторы могут объяснить неизвестные онкогенные механизмы. Анализ доступного для транспозазы хроматина с использованием секвенирования (Assay for Transposase-Accessible Chromatin, ATAC-seq) является быстрым и чувствительным методом изучения эпигенома. Для некоторых видов рака с его помощью уже были получены усредненные данные для слоев опухолевых клеток разных типов. Разработка методологии ATAC-seq на уровне единичных ядер (snATAC-seq) обеспечивает гораздо лучшее разрешение для изучения эпигенома отдельной клетки. Сочетание snATAC-seq с секвенированием РНК единичных ядер (snRNA-seq) позволяет сопоставлять профили эпигенома и транскриптома в одних и тех же клетках и напрямую анализировать связи между доступностью хроматина и транскрипцией генов.
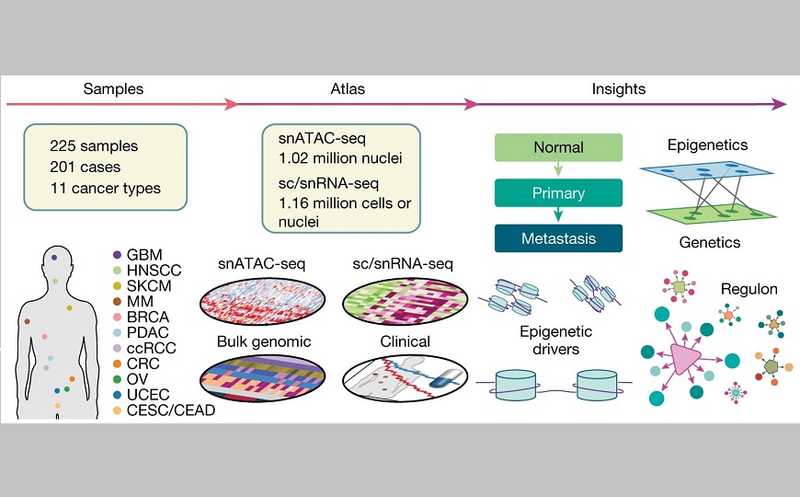
Команда ученых, возглавляемая исследователями из Вашингтонского университета в Сент-Луисе (США), создала мультиомный атлас для 11 основных типов рака. Большое количество образцов и значительная представленность типов и состояний рака (нормальный, первичный и метастатический) позволяют всесторонне изучить эпигенетические факторы рака. Работа опубликована в журнале Nature.
В рамках Сети атласа опухолей человека Национального института рака (NCI Human Tumour Atlas Network, HTAN) ученые получили 225 образцов (158 образцов первичных и 52 образца метастатических опухолей, а также 15 образцов нормальных прилегающих тканей) от 201 пациента с 11 типами рака. Среди них были метастатические образцы колоректального рака, аденокарциномы протоков поджелудочной железы, меланомы, рака эндометрия тела матки, яичников, молочной железы и других опухолей. Они провели snATAC-секвенирование для всех 225 образцов и для 206 из них — РНК-секвенирование единичных клеток или ядер (sc/snRNA-seq).
Данные snATAC-seq были получены для 1 019 175 ядер из 225 образцов, в каждом из которых ученые определили доступные области хроматина (accessible chromatin regions, ACR). В среднем было выявлено 126 196 таких областей на образец, причем большинство из них были расположены в интронных (49,0%), дистальных межгенных (30,8%) и промоторных (8,6%) областях. Также ученые выявили 56 001 дифференциально доступную область хроматина (differentially accessible chromatin region, DACR), специфичную для тканей и раковых клеток, сравнивая каждый тип рака со всеми остальными.
Исследователи стремились найти генетические и эпигенетические изменения, лежащие в основе перехода от нормальных клеток к раковым. Вначале они определили популяции, названные ими ближайшие нормальные клетки (closest normal cells, CNC), например, секреторные эпителиальные клетки эндометрия для рака эндометрия тела матки и рака яичников. Исследователи использовали эти CNC для удаления тканеспецифичных сигналов и выявления характерных именно для раковых клеток изменений в доступности хроматина. Так, они обнаружили 22 187 и 29 074 области повышенной и пониженной доступности хроматина соответственно и сопоставили их с ближайшими генами, основываясь на расположении DACR по отношению к близлежащим сайтам начала транскрипции. При раке около 75% DACR способствовали изменению экспрессии ближайшего гена. Из них 53% DACR были обнаружены в энхансерных областях и 37% — в промоторных областях.
Далее ученые вычислили взаимосвязи между доступными областями хроматина (ACR) и экспрессией генов. Почти половина всех значимых связей находилась между генами и энхансерными областями, определенными в EpiMap, и большинство было специфичным для типа рака.
Далее ученые определили, какие связанные ACR и гены могут быть вовлечены в переход от нормальных клеток к первичным раковым. Например, гены транскрипционных факторов KLF6 и PPARG, связанные с одним и двумя энхансерами соответственно, становятся доступными в клетках аденокарциномы протоков поджелудочной железы. Экспрессия гена PPARG при раке связана с худшей выживаемостью, а его нокаут в клеточных линиях снижает пролиферацию клеток.
Ученые провели поиск эпигенетических программ, вовлеченных в развитие и метастазирование рака. Некоторые эпигенетические драйверы проявлялись при множестве раковых заболеваний (регуляторные области ABCC1 и VEGFA, мотивы GATA6 и семейства FOX), тогда как другие были специфичными для рака одного типа (регуляторные области FGF19, ASAP2 и EN1, мотив PBX3). Инициирование рака было связано с эпигенетическими изменениями, затрагивающими пути, вовлеченные в передачу сигналов TNF, развитие гипоксии и активность TP53. Ученые связали метастатический переход рака с изменениями, влияющими на эстрогеновый ответ, апикальные клеточные соединения и процесс эпителиально-мезенхимального перехода.
Таким образом, исследователи представили единую карту дифференциально доступных энхансеров и промоторов, эпигенетически регулируемых генов и транскрипционных факторов, которые важны для развития и метастазирования опухоли. По мнению авторов, это исследование подчеркивает потенциал транскрипционных факторов в качестве прогностических маркеров и способствует более глубокому пониманию молекулярных основ развития рака.
Источник:
Terekhanova N.V., et al. Epigenetic regulation during cancer transitions across 11 tumour types // Nature (2023). DOI: 10.1038/s41586-023-06682-5


 Меню
Меню





 Все темы
Все темы



 0
0