Генная терапия против хронической боли
Хронические боли — распространенная проблема, от них страдает по меньшей мере каждый пятый человек на Земле. Для их лечения авторы недавнего исследования предложили генотерапевтический подход — ингибирование регуляторного участка натриевого канала NaV1.7, ответственного за передачу болевого сигнала, избавило модельных грызунов от симптомов нейропатии.
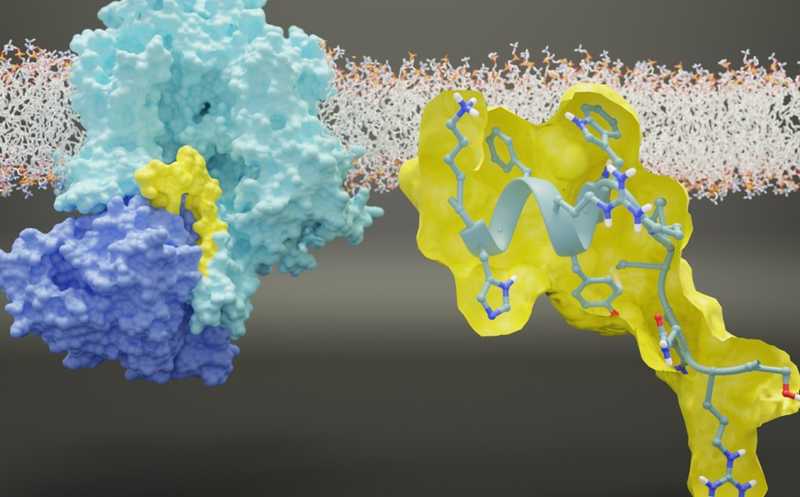
Взаимодействие между потенциалзависимым натриевым каналом NaV1.7 и его регулятором CRMP2.
Credit:
Samantha Perez-Miller and Rajesh Khanna (New York University)
Хронические боли — серьезная проблема здравоохранения, которая снижает качество жизни значительной доли населения. В передачу такой боли вовлечена особая изоформа потенциалзависимых натриевых каналов — NaV1.7. Терапия малыми молекулами, нацеленными непосредственно на этот ионный канал, пока не увенчалась успехом. Авторы недавней работы обнаружили в NaV1.7 регуляторный внутриклеточный участок, который и стал новой мишенью для разработки терапии хронической боли.
Исследователи выяснили, что контроль активности NaV1.7 осуществляется при участии цитозольного белка — медиатора коллапсинового ответа 2 (CRMP2). Этот белок высокоспецифично связывается с регуляторной последовательностью (CRS) во внутриклеточной части NaV1.7, уникальной для этой изоформы. Ученые ограничили это взаимодействие с помощью пептида NaV1.7-CRS, который связывался с CRMP2 и тем самым препятствовал активации NaV1.7. Доставку пептида в нейроны они осуществляли с помощью аденоассоциированного вирусного вектора (AAV). Целью доставки в данном случае были нейроны ганглиев дорсальных корешков, отвечающие за ноцицепцию.
Оказалось, что связывание CRPM2 с NaV1.7 важно для поддержания мембранной локализации последнего — блокировка их взаимодействия уменьшала поверхностную экспрессию NaV1.7 на 64%. Интернализация этого канала существенно уменьшала плотность тока, входящего в целевые нейроны и снижала их возбудимость.
Полученный генотерапевтический подход исследователи протестировали на крысах и мышах. Блокировка работы NaV1.7 у крыс не влияла на нормальную ноцицепцию — подопытные животные по-прежнему воспринимали острые болевые стимулы, боль воспалительной или послеоперационной природы. Моторная функция при ингибировании NaV1.7 также не затрагивалась — это выгодно отличает новый подход от многих анальгетиков, побочным эффектом которых часто оказываются нарушения моторики.
Более детально эффективность препарата ученые исследовали на мышиных моделях. После интратекальной инъекции 1×1010 AAV с плазмидой, кодирующей целевой пептид, авторы подтвердили его экспрессию в ганглиях дорсальных корешков и в спинном мозге. Исследование велось на модельных мышах, страдавших разными формами аллодинии (болевой чувствительности к раздражителям, которые в норме боль не вызывают) — например, механической или температурной. У получавших инъекцию животных это патологическое состояние проходило, причем эффект сохранялся в течение более 30 дней. Внецелевых эффектов, таких как нарушения естественной ноцицепции, исследователи не выявили. Моторная функция и поведенческие реакции также оставались в норме.
Одной из изученных моделей хронических болей была нейропатия, вызванная паклитакселом. Это распространенный противораковый препарат, в числе побочных эффектов которого — повреждение периферических нервов и развитие хронических болей у пациента. Эффективность нового подхода в таких случаях его создатели испытали на мышиной модели. Мыши получали четыре инъекции паклитаксела. Затем, когда на этом фоне развивалась нейропатия, им вводили аденовирусный вектор, кодирующий NaV1.7-CRS. Оказалось, что и в этом случае генотерапевтический агент существенно ослаблял хронические боли.
Важность этого эффекта подчеркивает доктор Раджеш Ханна, директор Центра изучения боли Нью-Йоркского университета и профессор молекулярной патобиологии в Стоматологической школе Нью-Йоркского университета: «В настоящее время существует значительная потребность в новых методах устранения боли, в том числе у онкологических больных с нейропатиями, вызванными химиотерапией. Наша долгосрочная цель — разработать генную терапию, которую пациенты могли бы получать для более эффективного лечения болезненных состояний и улучшения качества их жизни».
Таким образом, исследователи продемонстрировали новый подход к борьбе с хронической болью. Нацеливание на регуляторный участок натриевого канала NaV1.7, отвечающего за передачу болевых ощущений, зарекомендовало себя как эффективный и специфичный подход, в отличие от предыдущих способов, направленных на прямое ингибирование работы NaV1.7.
Цитата по пресс-релизу
По профилю микроРНК можно определить происхождение хронической боли
Источник
Gomez K. et al. Identification and targeting of a unique NaV1.7 domain driving chronic pain // PNAS (2023). DOI: 10.1073/pnas.2217800120


 Меню
Меню





 Все темы
Все темы




 0
0







