Генная терапия вернула мышам подвижность после травмы спинного мозга
Ученые из Германии вернули способность ходить мышам с поврежденным спинным мозгом. Дизайнерский цитокин, доставленный в нейроны при помощи вирусного вектора, может перемещаться между нейронами, запуская сигнальный путь, необходимый для регенерации аксонов.

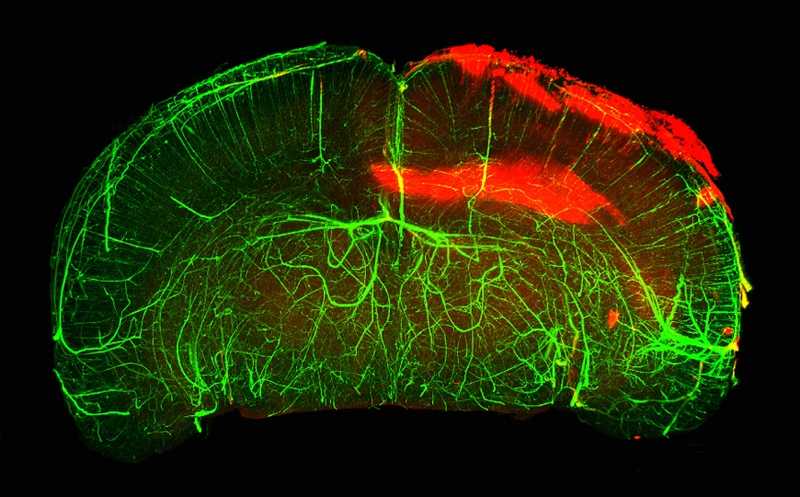
Мыши, получившие вектор с геном цитокина, с нокаутом PTEN и без, через неделю и восемь недель после травмы
Credit:
Nature Communications (2021), DOI: 10.1038/s41467-020-20112-4 | CC.BY 4.0
Восстановление двигательной активности после серьезных травм спинного мозга остается трудной задачей. У млекопитающих способность аксонов нервных клеток к регенерации сильно снижается с возрастом, поэтому травмы зачастую приводят к параличу.
Стимулировать регенерацию аксонов могут сигнальные молекулы цитокины. Исследователи из Рурского университета ранее показали эффект дизайнерского варианта интерлейкина-6 (hyper-IL-6, или hIL-6) как активатора сигнального пути JAK/STAT3. Этот сигнальный путь связывают с регенерацией аксонов центральной нервной системы. В отличие от природного варианта, hIL-6 имеет дополнительный домен, который позволяет ему связываться с рецептором GP130, экспрессирующимся почти всеми нейронами организма. Специфичные рецепторы для IL-6, напротив, не так распространены в нейронах.
Авторы работы ставили целью проверить, возможно ли с помощью hIL-6 вернуть подвижность взрослым мышам с серьезными повреждениями спинного мозга.
Сначала здоровым мышам ввели в двигательную кору головного мозга векторы на основе аденоассоциированного вируса (AAV), экспрессирующие hIL-6. Цитокин, как и ожидалось, вызвал фосфорилирование STAT3, этот эффект достиг максимума через неделю после инъекции и сохранялся на протяжении как минимум восьми недель.
Далее другой группе мышей в возрасте семи недель повреждали спинной мозг и сразу вводили AAV вектор с hIL-6. При этом у части мышей из экспериментальной и контрольной групп нокаутировали ген PTEN. Ранее другие ученые показывали, что этот нокаут запускает регенерацию нейронов, но не помогает восстановить подвижность конечностей.
У мышей которые получили hIL-6, через восемь недель аксоны выросли на 6 мм. Это намного превосходило эффект нокаута PTEN (1,5 мм); при совместном применении вектора с цитокином и нокаута PTEN удалось достичь 7 мм. Также ученые оценили действие двух подходов на двигательные функции животных. Нокаут PTEN не показал улучшения по сравнению с контрольной группой, а применение hIL-6, напротив, позволило мышам полноценно ходить через некоторое время после инъекции.
Из-за того, что нокаут PTEN не оказывал никакого благоприятного воздействия на функции опорно-двигательного аппарата, ученые предположили, что в основе эффекта hIL-6 лежит не только регенерация аксонов кортикоспинального тракта. Ранее с восстановлением подвижности связывали серотонинергические аксоны, поэтому авторы решили проверить роль серотонинергических нейронов. В самом деле, их аксоны активно регенерировали у мышей, получивших вектор с hIL-6. А когда мышам, восстановившимся после повреждения позвоночника, ввели нейротоксин, специфичный к серотонинергическим нейронам, животные снова утратили возможность двигать задними конечностями.
Чтобы узнать, каким образом инъекция в левую часть двигательной коры мозга восстанавливает подвижность в обеих конечностях животного, и каким образом стимулируются нейроны мозгового ствола, исследователи провели ряд экспериментов in vivo и in vitro. Выяснилось, что hIL-6, который вырабатывают нейроны после трансдукции вектором, передается другим нейронам через аксоны и синапсы и достигает продолговатого мозга. Доступ регенеративной стимуляции к таким структурам обычно затруднен, а между тем он очень важен для восстановления подвижности.
Авторы статьи отмечают, что эффект предложенного подхода можно еще улучшить сочетанием с другими терапевтическими стратегиями, такими как нейтрализация внеклеточных ингибиторов на участке поражения или перекрытие его трансплантантами.
Источник
Leibinger, M. et al. // Transneuronal delivery of hyper-interleukin-6 enables functional recovery after severe spinal cord injury in mice. // Nature Communications, 12:391 (2021), published 15 January 2021. DOI: 10.1038/s41467-020-20112-4








 Меню
Меню





 Все темы
Все темы





 0
0