ГликоРНК и связывающие их белки — новая мишень для терапии острого миелоидного лейкоза
Одна из трудностей лечения острого миелоидного лейкоза (ОМЛ) — поиск специфичной мишени, которая отсутствовала бы на здоровых клетках. Такой мишенью может стать недавно открытый класс биополимеров — гликозилированные РНК, точнее, РНК-связывающий белок нуклеофозмин 1 (NPM1), который вместе с ними формирует кластеры на поверхности раковых клеток. Авторы статьи в Nature Biotechnology охарактеризовали NPM1 как антиген, характерный для клеток ОМЛ и не представленный на нормальных, в том числе гемопоэтических клетках. Моноклональное антитело к этому белку уничтожало раковые клетки и их предшественники в различных мышиных моделях.
Гликозилированные РНК, или гликоРНК — особый класс небольших некодирующих РНК, обычно ассоциированных с поверхностью клетки. До недавнего времени считалось, что РНК не подвергаются гликозилированию, за исключением отдельных случаев тРНК. Однако в 2021 году группа под руководством нобелевского лауреата Каролин Бертоцци впервые показала их существованиев различных клетках, а в 2024 была установлена природа химической связи между остатком сахара и РНК. Функциональная роль гликоРНК в клетке оставалась не вполне ясной, однако как минимум некоторые из них оказались способны связываться с Siglec-рецепторами (иммуноглобулиноподобными лектинами), которые участвуют в регуляции иммунного ответа на патоген или злокачественную опухоль. Теперь авторы статьи в Nature Biotechnology показали, что гликоРНК связываются с белками на поверхности раковых клеток и формируют кластеры, которые могут стать мишенью для противоопухолевой терапии.
Исследователи занимались разработкой иммунотерапии острого миелоидного лейкоза (ОМЛ) — они искали поверхностный антиген раковых клеток, который оказался бы достаточно уникальным, чтобы стать безопасной мишенью препаратов. Нацеливание на поверхностные антигены ОМЛ остается сложной задачей, поскольку многие из них присутствуют и в жизненно важных здоровых тканях, включая гемопоэтические стволовые клетки. Поиск такого уникального антигена привел к обнаружению нуклеофозмина 1 (NPM1) — этот РНК-связывающий белок обычно имеет ядрышковую локализацию и способен выходить в цитоплазму, но у клеток ОМЛ он обильно представлен на поверхности.
Изначальный анализ структуры и локализации позволил предположить, что NPM1 может подвергаться гликозилированию, что согласуется с предыдущими данными. Высокий уровень экспрессии этого белка на поверхности подтвердился как в клетках ОМЛ человека, так и в мышиных моделях.
Затем авторы провели микроскопию сверхвысокого разрешения в сочетании с иммуноокрашиванием живых клеток, чтобы охарактеризовать локализацию NPM1 на уровне единичных молекул. Они обнаружили кластеры, которые располагались на одинаковом расстоянии друг от друга — примерно 300-330 нм. По размеру молекул кластеры делились на два типа: одни содержали 50–80 молекул NPM1, другие — 120–140.
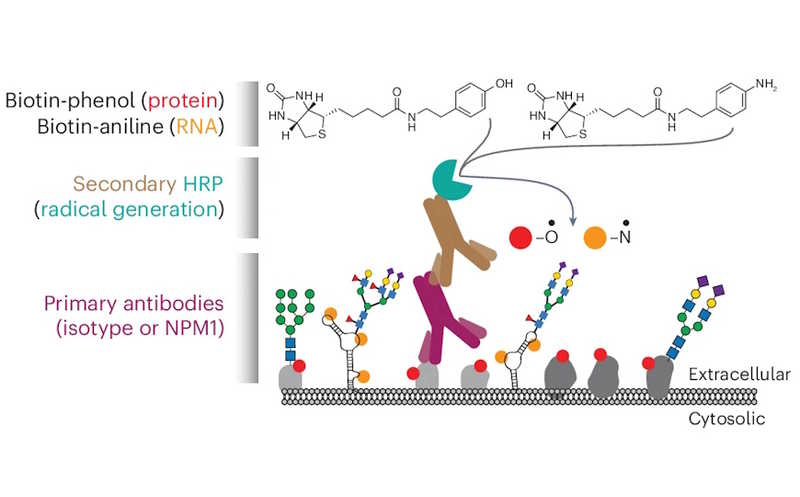
Чтобы выяснить, какие еще компоненты входят в состав этих кластеров, авторы воспользовались той же стратегией биоортогонального мечения, которая ранее позволила описать гликоРНК. Первичное антитело было специфично к NPM1, вторичное — конъюгировано с пероксидазой хрена (HRP), пероксидазой хрена (HRP), которая в присутствии пероксида водорода активирует биотин-фенол или биотин-анилин для мечения белков или РНК клеточной поверхности. Оказалось, что поверхностные кластеры, в состав которых входил исследуемый антиген, состояли преимущественно из РНК-связывающих белков.
После этого исследователи занялись разработкой терапевтического антитела, нацеленного на поверхностных NPM1. За основу они взяли вариант из ранее полученной библиотеки человеческих scFv, и на его основе сконструировали мышиное IgG2a моноклональное антитело (mAb2).
Анализ связывания mAb2 с лизатами цельных клеток или экстрагированных мембран подтвердил аффинность антитела к NPM1. Результаты воспроизвелись на проточной цитометрии живых клеток и подтвердились с помощью конфокальной микроскопии — антитело локализовалось на поверхностных участках клеток.
Однако для безопасного терапевтического применения важно, чтобы антитело нацеливалось на раковые клетки, избегая здоровых. Исследователи подтвердили, что поверхностный NPM1 служит маркером злокачественных клеток миелоидного происхождения и отсутствует на здоровых гемопоэтических стволовых клеток. Это должно позволить избежать токсических побочных эффектов, наблюдаемых при нацеливании на другие мишени ОМЛ, например, CD33.
Далее ученые проверили антилейкемическую активность mAb2 на мышах. Они использовали модель первичного ОМЛ с высоким уровнем поверхностного NPM1. После развития лейкоза мыши еженедельно получали терапевтическое антитело либо изотипический контроль в дозе 5 мг/кг массы тела. Через четыре недели такой терапии уровень лейкемических клеток в крови животных сократилось. Терапия также значительно увеличила общую выживаемость мышей по сравнению с контрольной группой. Более подробный анализ показал, что mAb2 способствует уничтожению не только самих раковых клеток, но и злокачественных стволовых клеток, которые дают начало ОМЛ.
Для выявления механизма авторы статьи повторили эксперимент на иммунодефицитных мышах (NOD-SCID-gamma, NSG), у которых отсутствуют NK-клетки, необходимые для антитело-зависимой цитотоксичности, и нарушена система комплемента. Разработанное антитело оказалось неэффективным в такой модели. Это позволяет предположить, что механизм действия mAb2 зависит от ADCC и/или комплемент-зависимой цитотоксичности.
Наконец, чтобы оценить применимость mAb2 в клинике, ученые протестировали его в модели ксенотрансплантата, полученного от пациента с ОМЛ. Болезнь в данном случае была вызвана перестройкой метилтрансферазы MLL, которая встречается в 40% детских и в 5-12% взрослых лейкозов. В клетках ксенотрансплантата подтвердился высокий уровень поверхностного NPM1. Введение mAb2 приводило к значительному увеличению выживаемости мышей и снижало опухолевую нагрузку, подтверждая перспективность mAb2 in vivo и в клиническом контексте.
Источник
George, B.M., et al. Treatment of acute myeloid leukemia models by targeting a cell surface RNA-binding protein. // Nat Biotechnol (2025). DOI: 10.1038/s41587-025-02648-2


 Меню
Меню





 Все темы
Все темы




 0
0








