Нобелевская неделя 2022. Каролин Бертоцци: «Превратить мышь в реакционную колбу»
«Если вы хотите запустить химическую реакцию в живом организме, то вы больше не в стеклянной колбе. У вас больше нет контроля над всеми параметрами, и вам предстоит решать множество интересных проблем». Лекция лауреата Нобелевской премии по химии 2022 года Каролин Бертоцци. 08.12.2022

«Биоортогональная химия — одна из технологий, возникновение которых было вдохновлено еще не удовлетворенной потребностью в биологической и медицинской науке. Фундаментальной целью было создать новый тип химических реакций, которые могут осуществляться в самых сложных, по моему мнению, химических реакционных сосудах — в живых организмах». Если реакция протекает в химической посуде, ее условия легко контролировать. Однако в живых системах у ученого больше нет контроля над условиями. Самая сложная система, в которой ученые хотели бы осуществлять химические реакции, — это организм человека, и для такой ответственной задачи нужен был новый подход. Так Каролин Бертоцци объяснила, как началась ее работа по развитию биоортогональной химии, которую она использовала для присоединения флуоресцентных меток — зондов — к биомолекулам в клетке.
Биоортогональные реакции — это реакции между компонентами, которые не взаимодействуют с биосистемой и не вмешиваются в ее работу. «Я представляю себе биологическое реакционное пространство как галактику из соединений в составе гораздо большей вселенной соединений; эта галактика большая, но у нее есть границы. Где-то за пределами этого пространства биологических реакций существует пространство биоортогональных реакций — другая галактика из других соединений. Они содержат функциональные группы, которых не найти в биохимических соединениях живых организмов, и эти группы реагируют друг с другом независимо от того, окружены ли они биологическими молекулами».
Мотивацией для создания такой «новой вселенной» была биологическая задача, которой в тот момент занималась Бертоцци. Ее лаборатория исследовала изменения в гликозилировании поверхности клеток (в составе сложных углеводов на мембране). В 1990-е уже было известно, что когда клетка претерпевает какие-то изменения в своем состоянии, например, превращается в раковую, состав ее поверхностных углеводов сильно меняется. Например, в составе поверхностных полисахаридов раковых клетках повышается содержание определенного мономера — сиаловой кислоты. Целью группы, в которой тогда работала Бертоцци, было научиться получать изображения сиаловой кислоты на поверхности здоровых и раковых клеток, определять и сравнивать ее содержание. В отличие от флуоресцентного мечения нуклеиновых кислот и белков, которое уже было развито в те годы, технологий получения изображений поверхностных сахаров не существовало. Создание такого метода стало главной задачей постдокторской работы Каролин.
Вот как она описывает начало своей карьеры. «В 90-е годы мне довелось посетить конференцию в Саутгемптоне в Англии, это стало для меня счастливой случайностью. Там я услышала лекцию покойного профессора Вернера Ройтера (Werner Reutter), очень известного немецкого биохимика из Свободного университета Берлина. Его лаборатория исследовала пути биосинтеза сиаловой кислоты и ее транспорта к поверхности клетки. На этой конференции он доложил, что можно "накормить" клеточную культуру модифицированной формой предшественника сиаловой кислоты — N-ацетилманнозамина. Модификация происходит в ацетильной группе: к метильной группе можно добавить несколько атомов углерода. Ферменты биосинтеза сиаловой кислоты все еще узнают такой предшественник и вставляют его в биополимер, который затем появляется на поверхности клетки. Я предположила, что в эту модификацию можно вставить реакционноспособную группу, и как только она появится на поверхности клетки, мы можем химически присоединить к ней флуоресцентный зонд». Таким образом, полисахарид на поверхности клетки имеет химическую группу X, а химическая метка — комплементарную группу Y, и когда X и Y встречаются друг с другом, они реагируют, и метка «пришивается» к полисахариду. Каролин подала эту идею в своей заявке на исследовательскую позицию в университете Беркли.
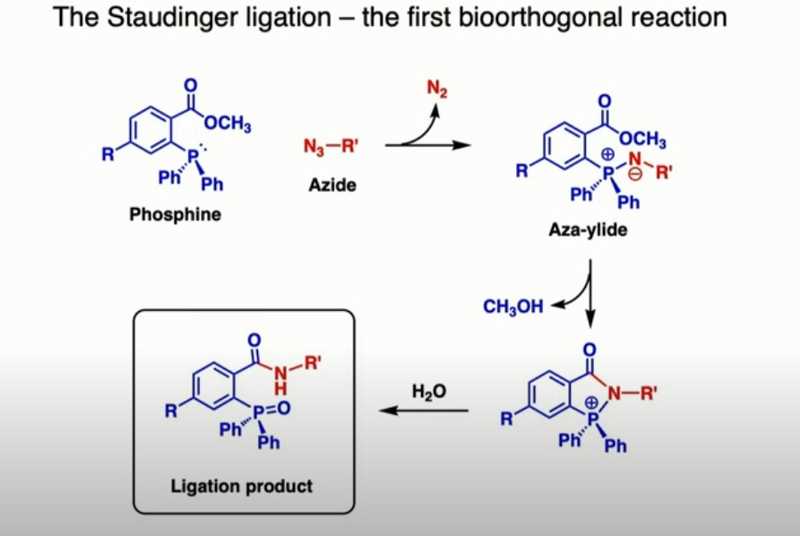
Одной из ключевых задач был выбор групп X и Y, ведь они должны без проблем реагировать в живых системах. Это оказалось отправной точкой в рождении биоортогональной химии. Первыми реагентами в биоортогональных реакциях стали производные фосфинов и азидов. Они реагируют друг с другом с образованием продукта — аза-илида — по механизму, открытому немецким ученым Германом Штаудингером в 1919 году. Штаудингер получил за свое открытие Нобелевскую премию в 1953 году. Фосфины и азиды не встречаются в биологических системах и очень избирательно реагируют только друг с другом. Однако есть проблема, препятствующая использованию этих веществ в биоортогональных реакциях, — нестабильность продукта (аза-илида) в воде. Чтобы применять эту реакцию в водной среде живой клетки, одна из аспиранток Бертоцци, Элиана Саксон, химически модифицировала исходный фосфин, добавив к нему метилэфирную группу. В результате атом азота внутри молекулы аза-илида нуклеофильно атакует эфирную группу с образованием циклического продукта. При гидролизе циклического продукта образуется амидная группа, которая образует ковалентную связь между двумя исходными реагентами. Модификацию назвали лигированием по Штаудингеру.
Каролин вспоминает: «Я нашла эту старую фотографию, сделанную в день, когда Элиана получила свой первый большой результат. День, когда она показала, что лигирование по Штаудингеру может быть проведено в культуре клеток без вреда для них. Она пришла в мой офис, показала свои данные, и я помню, как я подумала: вот это действительно большой результат! Это было очень давно, когда моя лаборатория еще была новой».
Когда исследователи из группы Бертоцци поняли, что лигирование по Штаудингеру работает в живых системах, они смогли применить его не только к сиаловой кислоте, но и к другим мономерам поверхностных полисахаридов — например, к фукозе и N-ацетилгалактозамину.
«Затем пришел другой важный момент в развитии моей лаборатории. Двое аспиранток, Дженн Прешер и Даниэлла Дуби, показали, что лигирование по Штаудингеру может быть использовано для присоединения меток к поверхностным сахарам в живых мышах. Это доказало, что живые системы могут переносить биоортогональные реакции настолько хорошо, что их можно проводить в организме мыши без токсичных побочных эффектов». Азидо-ацетил-маннозамин можно вводить мышам с помощью инъекций, и он будет вступать в нормальный клеточный метаболизм и появляться на клеточной поверхности. На второй стадии мышам вводят зонд с активной фосфиновой группой, и он находит производные азида и связывается с ними. Продукт реакции можно детектировать различными способами, включая флуоресцентно меченые антитела (в таком случае производное фосфина несет на себе эпитоп, или таг). «Это было значительным достижением этих бесстрашных студентов, которые мечтали превратить мышь в реакционную колбу».
К сожалению, у лигирования по Штаудингеру был важный недостаток: при температуре живых организмов реакция шла очень медленно. Она занимала часы, а иногда и дни. С точки зрения кинетики, это бимолекулярная реакция, скорость которой пропорциональна произведению константы скорости реакции и концентраций двух исходных веществ. В живом организме концентрации реагентов очень низкие, так как животное метаболизирует введенные в него соединения. Количество введенного вещества также ограничено его растворимостью и токсичностью. Для повышения скорости важно найти реакцию с высокой константой (постоянной, присущей конкретным реакциям). Группа Бертоцци начала поиск других веществ, которые могут вступать в биоортогональные реакции с азидами.
Они решили попробовать другую давно известную реакцию — 1,3-диполярное циклоприсоединение азидов к алкинам. Над механизмом реакции работал профессор Рольф Хьюсген в университете Мюнхена в Германии в середине XX века. Как и реакция Штаудингера, эта реакция является биоортогональной, поскольку алкины крайне редко встречаются в биологических соединениях.
Оригинальная реакция Хьюсгена при комнатной температуре гораздо медленнее реакции Штаудингера, однако в 2022 году произошло открытие, изменившее правила игры. Двое ученых, которые разделили Нобелевскую премию по химии этого года с Каролин Бертоцци, Мортен Мельдаль и Барри Шарплесс, открыли катализатор на основе меди (I), который значительно ускоряет реакцию Хьюсгена, позволяя ей проходить за минуты. Так родилась область, называемая клик-химией. Но для изучения живых организмов этого открытия все еще было недостаточно: катализатор оказался токсичным. Как же ускорить реакцию без добавления этого соединения? Бертоцци продолжила поиски.
Ответ был найден в довольно неожиданном источнике. Каролин читает студентам лекции по основам органической химии, в который входит лекция по энергии углового напряжения в циклоалканах. Если в молекуле атомы углерода соединены под «неудобным» углом, это может повышать реакционную способность боковых групп. Например, введение боковых групп с двойными связями в трехчленный цикл может повысить реакционную способность и увеличить скорость реакции. «Один из моих студентов, Ник Эйгард, пошел в библиотеку, которые тогда еще существовали, и нашел пример такой реакции». В 1961 году еще один лауреат Нобелевской премии по химии, Георг Виттиг, вместе с коллегами опубликовал реакцию циклооктина (наименьшего из стабильных циклоалкинов) с фенилазидом. Реакция шла взрывообразно при комнатной температуре без катализатора. Ник и другие коллеги разработали зонды на основе циклооктина для клик-химии «без меди». Используя разные модификации циклооктина, можно регулировать кинетику реакций циклоприсоединения.
С этими новыми соединениями Джереми Баскин и Скотт Лофлин из лаборатории Бертоцци снова перешли к работе с живыми организмами. В качестве модели они выбрали эмбрион рыбки данио рерио, чьим достоинством является прозрачность, позволяющая легко получать флуоресцентные изображения. В среду с эмбрионами добавляли азидное производное моносахарида, а затем производное циклооктина с зондом для окраски. Если добавлять азидные и циклооктиновые производные в разные моменты времени или с разными сахарами, то можно прикреплять к сахарам метки разных цветов и изучать развитие организма во времени. Так, в лаборатории Бертоцци впервые получили в высоком разрешении изображение распределения поверхностных полисахаридов во время деления клетки в раннем эмбрионе данио (до этого ученые получали только изображения белков и нуклеиновых кислот). Оказалось, что сахара концентрируются в области перетяжки между дочерними клетками и вносят вклад в деление.
Стоило Бертоцци показать результаты на эмбрионах данио, как множество исследователей обратились к ней за реагентами, чтобы опробовать их на других классах биомолекул. Сейчас биоортогональные реакции разработаны не только для полисахаридов, но и для липидов, низкомолекулярных метаболитов, нуклеиновых кислот и белков.
Другие группы также расширили список реагентов для биоортогональных реакций. Например, тетразины могут реагировать с алкинами и также быть нейтральными для живых клеток. «Я брошу вызов студентам и тем, кто начинает карьеру в органической химии: если вы придумаете новую идею биоортогональной химии, это будет иметь очень большое значение, так как несмотря на то, что сейчас уже известен ряд реагентов, всегда есть спрос на больший выбор».
Биоортогональные реакции находят все больше практических применений. Изначально лаборатория Бертоцци занималась фундаментальными вопросами, но сейчас технологию применяют в разработке новых лекарств и диагностике. Очень популярно создание конъюгатов лекарств с антителами для адресной доставки. Несколько биотехнологических компаний делают конъюгаты вакцин, и некоторые из них проходят клинические испытания. Каролин Бертоцци является научным консультантом в компании, которая проводит биоортогональные реакции на онкобольных, чтобы очень избирательно доставлять химиотерапевтические агенты в опухолевые ткани.
В заключение Бертоцци отметила ценность фундаментального интереса к науке. «Я хочу сделать важное замечание: несмотря на широко продемонстрированное практическое применение, я считаю, что главный урок из моей истории — важность фундаментальных исследований, подогреваемых любопытством. Среди нас есть ученые, которым знакомо противостояние фундаментальной и прикладной науки; грантовые агентства также часто имеют разные стратегии. Биоортогональные реакции — это история о том, как важны бывают чистые фундаментальные исследования для того, чтобы затем изобрести применение. Я уверена, что когда ученые-химики, на чьих плечах стояла, когда сделала свои открытия — Герман Штаудингер, Рольф Хьюсген, Георг Виттиг, — публиковали открытые ими механизмы реакций, они не могли предвидеть, что сегодня я буду показывать вам флуоресцентных рыбок данио».
Каролин Бертоцци поблагодарила свою альма-матер — университет Беркли, где сделала первые прорывные работы, Стэнфордский университет, где она продолжает исследовать прикладное применение биоортогональных реакций, своей семье, а самое главное — своим коллегам и студентам, чьими руками были сделаны ее работы.


 Меню
Меню





 Все темы
Все темы




 0
0







