Гликозилированные сайты S-белка коронавируса — потенциальная мишень терапии
Международная группа ученых проанализировала библиотеку лектинов мыши и обнаружила два белка, CD209c и Clec4g, которые связывают углеводные остатки в S-белке коронавируса. Человеческие ортологи hCD209 и hCLEC4G обладают схожими свойствами. hCLEC4G, Clec4g и CD209c связываются с высококонсервативным гликозилированным сайтом N343 в рецепторсвязывающем домене и препятствуют проникновению SARS-CoV-2 в клетки Vero E6 и Calu3.
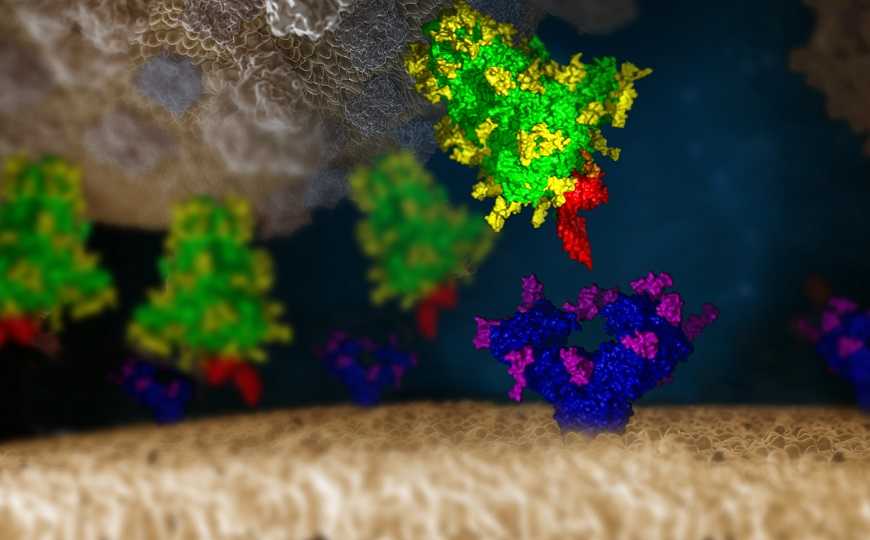
SARS-CoV-2 (сверху) и клетка (снизу). Зеленым обозначен S-белок, желтым — гликаны, синим — ACE2, фиолетовым — тоже гликаны, красным — лектин Clec4g.
Credit: ©IMP/IMBA Graphics 2021. The protein and glycan structures were provided by Chris Oostenbrink (BOKU) | Пресс-релиз
Международная группа ученых под руководством Джозефа Пеннингера, директора Института естественных наук в Университете Британской Колумбии (Ванкувер, Канада), разрабатывала универсальное терапевтическое средства для борьбы с COVID-19, которое не зависело бы от штамма коронавируса. Это непростая задача, так как требуется найти консервативный участок, который присутствует в любом вирулентном штамме.
Особый интерес представляет S-белок, за счет которого коронавирус проникает в клетку путем связывания с рецептором ACE2 на ее поверхности. Для маскировки от иммунной системы организма хозяина коронавирус использует аппарат гликозилирования клетки, который присоединяет многочисленных остатков сахаров к S-белками. С этими остатками могут связываться белки лектины. Авторы исследования нашли лектины, которые связывают коронавирус и не дают ему взаимодействовать с ACE2.
Для этого они клонировали, экспрессировали и очистили 143 углевод-распознающих домена лектинов мыши. В конце концов отобрали два белка: CD209c и Clec4g, которые связываются с S-белком SARS-CoV-2. Также авторы обнаружили ортологи мышиных лектинов у человека (hCD209 и hCLEC4G), также обладающие высокой аффинностью к S-белку. У человека эти белки располагаются на поверхности макрофагов, дендритных клеток, а также эндотелиальных клеток печени и лимфатических узлов.
Авторы изучили, как именно происходит связывание, и с какими остатками сахаров взаимодействуют лектины. Оказалось, что лектины связываются с высококонсервативным сайтом в рецепторсвязывающем домене, N343, мутации в котором приводят к снижению стабильности S-белка. «Это означает, что наши лектины связываются с сайтом, который является необходимым для правильного функционирования S-белка, поэтому крайне маловероятно, что возникнет штамм, у которого будет отсутствовать этот гликан», — объясняет Стефан Мерайтер, исследователь их Института молекулярной биотехнологии Австрийской академии наук и один из авторов работы.
В опытах на клетках Vero E6 и Calu3 авторы исследовали, могут ли лектины остановить заражение клеток. Оказалось, что hCLEC4G, Clec4g и CD209c, но не hCD209, препятствуют связыванию S-белка с поверхностью клетки.
В настоящее время идут клинические испытания препарата «APN01» (Apeiron Biologics), в состав которого входят биоинженерный человеческий ACE2, который тоже связывается с S-белком. Это препятствует проникновению вируса в клетки. В новом исследовании обнаружили природные белки млекопитающих, которые способны делать то же самое. По мнению авторов, их работа может послужить значимым толчком в разработке универсального лекарства против различных штаммов коронавируса.
Источник
Hoffmann D., et al. Identification of lectin receptors for conserved SARS-CoV-2 glycosylation sites // The Embo Journal, published 10 August, 2021. DOI: 10.15252/embj.2021108375


 Меню
Меню





 Все темы
Все темы




 0
0