GPR35 регулирует метаболизм липидов при метаболически ассоциированной жировой болезни печени
Исследователи из Китая при помощи пространственной транскриптомики и метаболомики выяснили, что белок GPR35 играет важную роль в регуляции липидного обмена, а его дисфункция может приводить к нарушению метаболизма и ускорению развития метаболически ассоциированной жировой болезни печени на высокожировой диете у мышей. При этом влияние GPR35 зависит от зоны печени, для каждой из которых характерен свой метаболом и профиль экспрессии генов.
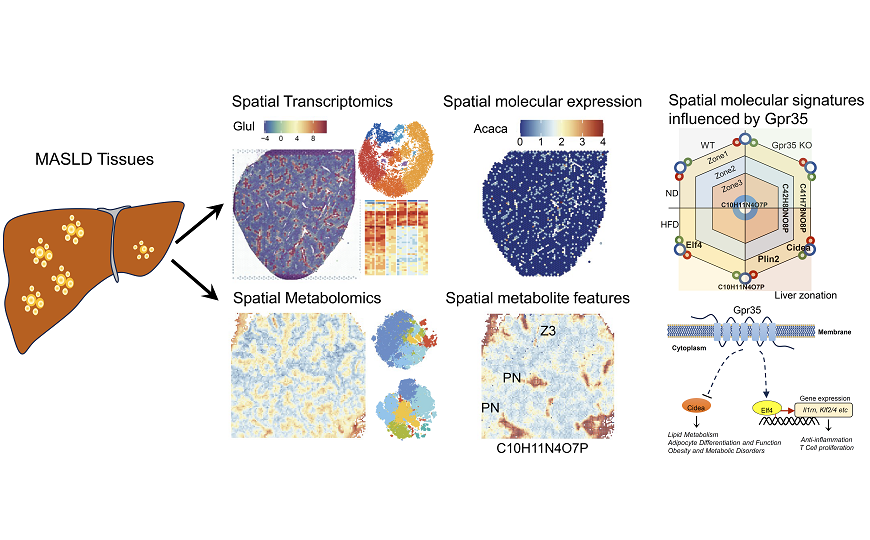
Метаболически ассоциированная жировая болезнь печени (MASLD) может прогрессировать, приводя к развитию стеатогепатита, ассоциированного с метаболической дисфункцией (MASH), цирроза и рака. Ранние исследования показали, что зонирование печени играет важную роль в координации сложных процессов, происходящих в этом органе. Печень делится на три метаболически различные зоны — зона 1, зона 2 и зона 3 от портальной вены к центральной вене. Каждая из них характеризуется уникальным профилем экспрессии генов и активности метаболитов. Нарушение зонирования печени связано с развитием MASLD, однако механизм слабо изучен.
GPR35, орфанный рецептор, сопряженный с G-белком, играет важную роль в регуляции липидного метаболизма, термогенеза и воспалительных реакций в жировой ткани, поддерживая энергетический гомеостаз. Хотя GPR35 рассматривался как потенциальная терапевтическая мишень для лечения MASLD и MASH, его роль в развитии заболевания и регуляции зоноспецифического метаболизма требует дальнейшего изучения.
Группа исследователей из Китая использовала пространственные метаболомику и транскриптомику для изучения характеристик зонирования печени и прояснения роли GPR35 в регуляции жировых заболеваний печени.
Для изучения влияния GPR35 на липидный метаболизм ученые разделили мышей дикого типа (WT) и с нокаутом Gpr35 (Gpr35 KO) на группы с нормальной диетой (ND) и диетой с высоким содержанием жиров (HFD). У мышей с нокаутом Gpr35 значительно увеличилась масса тела по сравнению с мышами WT после 10 недель на HFD, в то время как вес в обеих группах не отличался на ND. Через 14 недель исследователи показали, что у нокаутных мышей были больше жировые запасы и более выражен стеатоз печени. То есть нокаут Gpr35 усугублял течение MASLD.
Они также обнаружили изменения в уровне 20 метаболитов печени мышей WT и Gpr35 KO на разных диетах. Так, в печени мышей Gpr35 KO_HFD уровни три- и диглицеридов были значительно повышены. В целом липидный метаболизм был значительно активнее у Gpr35 KO_HFD мышей.
Далее исследователи определили пространственную гистологическую структуру печени и выявили шесть различных кластеров. Они также измерили уровни экспрессии в кластерах и обнаружили, что каждый кластер имеет уникальную генную экспрессию.
Авторы выделили кластер, в котором была повышена экспрессия амилоида плазмы A1/2/3 (Saa1, Saa2 и Saa3). Эти гены ранее были ассоциированы с плохим прогнозом и обычно связаны с повреждением печени. Этот кластер увеличивался с накоплением липидов.
Авторы сравнили профили экспрессии генов в печени мышей WT и с нокаутом Gpr35, а также при ND и HFD. Они выявили характерные паттерны в каждой зоне при сравнении KO vs WT и HFD vs ND. То есть развитие MASH регулирует координированная активность различных генов.
Далее исследователи изучили пространственное расположение метаболитов, получив в среднем 10 632–10 105 точек на образец. Большая часть этих метаболитов была фосфолипидами. Они выделили шесть и семь кластеров в зависимости от метода анализа. Эти кластеры хорошо соотносились с теми, что были получены ранее при анализе гистологической структуры.
У Gpr35 KO_HFD мышей в печени изменились уровни экспрессии генов, связанных с контролем воспаления, липогенезом и развитием MASH, таких как S100a11, Smad7, Zeb2, Smpdl3b, Hmgcr, Nck2, Hk1, Usp30, Elf4 и Cidea. Также в зоне 2 повысился уровень экспрессии гена Stard4, ассоциированного с MASH. Таким образом, связь между GPR35 и этими генами играет ключевую роль в развитии MASH при HFD.
Авторы отдельно проанализировали уровни экспрессии противовоспалительного фактора ELF4 и ключевого фактора липогенеза CIDEA в печени мышей при ND и HFD. У мышей WT при HFD в печени значительно повышалась экспрессия ELF4 в зоне 2, чего не наблюдалось у мышей с нокаутом Gpr35. То есть у мышей Gpr35 KO более выражено воспаление. Экспрессия CIDEA в зоне 1 была значительно выше у мышей Gpr35 KO, чем у WT при HFD. Таким образом, GPR35 играет важную роль в выработке липидов и прогрессировании MASLD.
По мнению авторов, понимание роли GPR35 в регуляции липидного метаболизма позволит в дальнейшем разработать методы терапии для MASLD и других жировых заболеваний печени.
Ускоренное старение отдельных органов повышает риски заболеваний
Источник:
Wuxiyar Otkur, et al., Spatial multi-omics characterizes GPR35-relevant lipid metabolism signatures across liver zonation in MASLD // Life Metabolism, 2024, DOI: 10.1093/lifemeta/loae021


 Меню
Меню





 Все темы
Все темы




 0
0







