Искусственная активация иммунитета бактерий поможет контролировать инфекции
У бактерий есть много способов защиты от бактериофагов, и один из них — это система CBASS, похожая на сигнальный путь cGAS—STING у млекопитающих. При активации этой системы бактерия погибает, но защищает колонию от заражения. Ученые определили структуру эффекторного белка Cap5 системы CBASS у бактерии Pseudomonas syringae и выяснили, как можно его активировать. Искусственная активация Cap5, встроенного в кишечную палочку, ограничивала рост бактериальной колонии. Авторы работы предлагают использовать такой метод для контроля бактериальных инфекций.
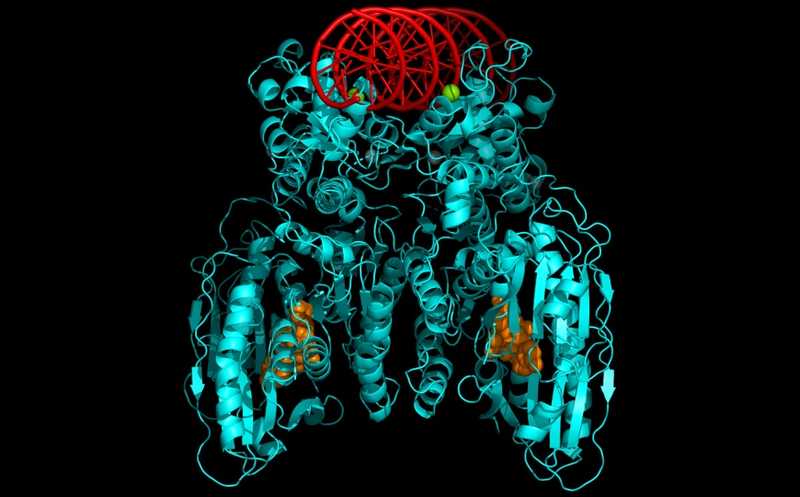
Структура тетрамера Cap5 (голубой), связанного с циклическими динуклеотидами (оранжевые) и молекулой ДНК.
Credit:
Rechkoblit et al., Nature Structural & Molecular Biology |
пресс-релиз
У человека и других млекопитающих для защиты от вирусов используется путь cGAS—STING, который относится к врожденному иммунитету. В ответ на присутствие цитозольной ДНК в клетке запускается фермент cGAS (цикло-ГМФ-АМФ-синтаза), который синтезирует цГМФ-АМФ. Этот циклический динуклеотид, в свою очередь, связывается с белком STING, который находится на эндоплазматическом ретикулуме. После активации STING сигнал передается далее, в результате чего запускается транскрипция провоспалительных генов. У бактерий есть аналогичная система защиты от бактериофагов, которая называется CBASS (cyclic oligonucleotide-based antiphage signaling system, антифаговая сигнальная система на основе циклических олигонуклеотидов). В состав этой системы входят два белка — cGAS/DncV-подобная нуклеотидилтрансфераза (CD-НТаза), которая распознает заражение клетки вирусом и синтезирует циклические олигонуклеотиды, и эффекторный белок семейства Cap. В отличие от STING, белки Cap не активируют транскрипцию, а приводят к гибели зараженной клетки. Хотя это и может показаться контринтуитивным на первый взгляд, зараженные бактериальные клетки совершают «суицид», чтобы защитить колонию и предотвратить распространение вирусной инфекции.
Авторы публикации в Nature Structural & Molecular Biology определили структуру эффекторного белка Cap5 в комплексе с его лигандами. Хотя Cap5 и довольно распространен среди бактерий, механизм его активации до сих пор оставался неясным.
В работе ученые исследовали белок Cap5 из бактерии Pseudomonas syringae — патогена растений. Они выделили и очистили этот белок, а потом провели ряд тестов, чтобы выяснить, какие именно циклические олигонуклеотиды могут его активировать. Известно, что Cap5 приводит к гибели бактериальной клетки из-за того, что нарезает геномную ДНК, поэтому в тесте к этому белку добавляли плазмиду и циклические ди-, три- и тетрануклеотиды, чтобы выяснить, в ответ на какой из них Cap5 начнет нарезать плазмиду.
Cap5 активировался в ответ на два циклических олигонуклеотида — 3`2`-цГАМФ и 3`2`-ц-диАМФ. При этом при добавлении к Cap5 3`2`-цГАМФ плазмида нарезалась на настолько маленькие фрагменты, что их было невозможно детектировать. При этом ученые отметили, что 2`3`-цГАМФ, который активирует STING у млекопитающих, не вызывал активации Cap5. Кроме того, симметричные динуклеотиды, такие как 3`3`-цГАМФ, тоже не приводили к разрезанию ДНК. Ученые объяснили это тем, что симметричные динуклеотиды вырабатываются бактериями в ходе нормальной жизнедеятельности и поэтому не должны приводить к активации противовирусной защиты.
Используя масс-фотометрию, ученые выяснили, что в растворе Cap5 присутствует преимущественно в форме димера. Однако при добавлении его лигандов — как 3`2`-цГАМФ, так и 3`2`-ц-диАМФ — он также образует тетрамеры. Далее с помощью программы ColabFold исследователи определили структуру Cap5. Протомер белка состоит из эффекторного домена SAVED и NHH-нуклеазного домена, которые соединены между собой альфа-спиралью. Когда белок образует активированный тетрамер, димеры скрещиваются между собой. В результате этого домен SAVED одного протомера образует лиганд-связывающий карман, а домен SAVED второго — «крышку», закрывающую этот карман. Из-за такой структуры белок Cap5 и может взаимодействовать с асимметричными циклическими динуклеотидами, но симметричные не способны его активировать.
Наконец, ученые экспрессировали Cap5 из P. syringae в E. coli, чтобы выяснить, можно ли искусственно активировать CBASS. Они добавляли в культуру кишечной палочки 3`2`-цГАМФ, и это значительно ограничивало и даже останавливало рост колоний. Так ученые показали, что циклические динуклеотиды могут пересекать даже клеточную стенку грамотрицательных бактерий, которая состоит из двух мембран. Соответственно, искусственная активация CBASS может использоваться в медицине для контроля бактериальных инфекций.
Вирусная РНК активирует у бактерий аналог пути cGAS
Источник
Rechkoblit, O. et al. Activation of CBASS Cap5 endonuclease immune effector by cyclic nucleotides. // Nature Structural & Molecular Biology (2024). DOI: 10.1038/s41594-024-01220-x


 Меню
Меню





 Все темы
Все темы




 0
0








