Как собираются митохондриальные рибосомы
Исследователи из России и Швеции подробно визуализировали и описали механизм формирования митохондриальных рибосом, в котором участвуют метилтрансферазы и другие белки. Ранее российские ученые показали, что правильная сборка митохондриальных рибосом важна для нормальной работы интеллекта и обучения у мышей. Кроме того, понимание структуры и функционирования миторибосом может быть полезно для разработки новых лекарств.
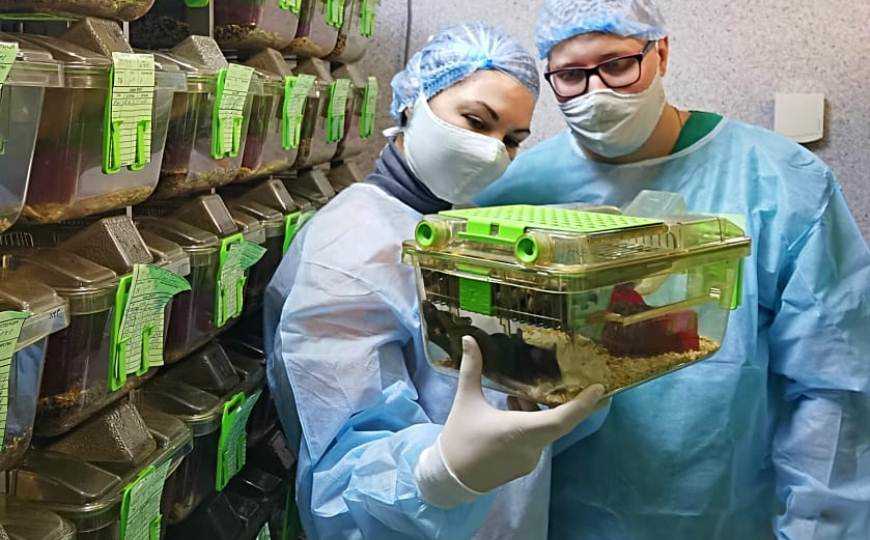
Сотрудники МГУ с мышами, нокаутными по гену метилтрансферазы миторибосомной РНК. Такие мыши слабее своих сородичей и неспособны к обучению
Credit:
Пресс-служба МГУ | Фото из личного архива Петра Сергиева
У митохондрий есть собственный геном и свои рибосомы — миторибосомы, которые тоже синтезируют белки. И хотя цитоплазматические рибосомы изучены хорошо, нам мало известно о том, как происходит сборка миторибосом. Сотрудники химического факультета и Института функциональной геномики МГУ, а также Сколтеха вместе с коллегами из Стокгольмского университета (Швеция) c помощью криогенной электронной микроскопии рассмотрели ключевые этапы формирования миторибосомы в эукариотических клетках.
Миторибосома человека состоит из малой субъединицы (SSU), связывающей мРНК и тРНК для обеспечения точной инициации и декодирования, и большой субъединицы (LSU), которая обеспечивает поступление растущего полипептида к внутренней митохондриальной мембране.
Как показали авторы работы, опубликованной в Nature, в сборке миторибосом участвуют шесть факторов: RBFA, TFB1M и METTL15 (метилтрансферазы), mtIF3, mS37 и mtIF2. Например, METTL15 — фермент, метилирующий РНК в составе SSU, — облегчает фолдинг РНК, способствует конформационным изменениям других белков и сборке белковых комплексов, а белок mS37 сигнализирует о том, что две субъединицы рибосомы могут быть соединены и готовы начать синтез белка.
Не исключено, что результаты этой работы найдут применение при разработке новых методов лечения рака и новых антибиотиков. Например, можно создать противораковый препарат на основе ингибитора митохондриальных рибосом раковых клеток. А изучение миторибосом может помочь разработать более безопасные антибиотики (бывает так, что антибиотики, нацеленные на синтез белка в бактериях, вредят митохондриям клеток хозяина из-за структурного сходства рибосом бактерий и миторибосом).
«Хотя механизмы бактериальной и цитозольной трансляции изучаются десятилетиями, мы только сейчас начинаем понимать, как митохондрии производят белки. Понимание различий в производстве рибосом у бактерий и митохондрий может позволить нам разработать лучшие и более точно нацеленные антибиотики», — говорит Джоанна Рорбах, одна из авторов работы, научный сотрудник и руководитель группы отдела медицинской биохимии и биофизики Каролинского института (Швеция).
Нарушение сборки митохондриальных рибосом в эукариотической клетке может приводить к патологиям. Два года назад те же ученые из МГУ открыли два фермента, которые модифицируют рибосомную РНК и участвуют в сборке миторибосом. Исследователи определили, как и когда включаются эти ферменты, как они влияют на сборку и что может пойти не так. Затем они начали сотрудничать со Стокгольмским университетом, с группой, которая изучает митохондриальные рибосомы, и вместе с ними исследовали рибосомы из генетически отредактированных клеток, в которых ключевые метилтрансферазы были инактивированы. Шведские ученые выделили из этих клеток недостроенные хромосомы, изучили их структуру и процесс сборки.
Затем исследователи проверили влияние роль этих модификаций на уровне организма. Мыши, у которых с помощью CRISPR-Cas нокаутировали ген метилтрансферазы Mettl15, оказалось жизнеспособными, в отличие от мышей с нокаутами других метилтрансфераз, имеющих аналогичную функцию. Но они были более слабыми, чем контрольные мыши, и не способными к обучению. (То и другое говорит о нарушении энергетических функций, которые обеспечиваются митохондриями.)
 Пресс-служба МГУ | Фото из личного архива Петра Сергиева
Пресс-служба МГУ | Фото из личного архива Петра Сергиева
«Мы пытались их обучать разными способами. Например, один из стандартных экспериментов заключается в том, что животное сажают в освещенный ящик, из которого есть несколько выходов. Все, кроме одного, заканчиваются тупиком, один же ведет в ее домашнюю клетку, где ей уютно и комфортно. Нормальная мышь, найдя правильный выход, запоминает его, и в следующий раз сразу бежит к нему. Но мышь с инактивированными ферментами запомнить правильный путь не может и раз за разом ищет его заново», — рассказывает один из соавторов работы, профессор кафедры химии природных соединений химического факультета и директор Института функциональной геномики МГУ, член-корреспондент РАН Петр Сергиев.
Источник
Itoh Y., et al. Mechanism of mitoribosomal small subunit biogenesis and preinitiation // Nature, published June 8, 2022, DOI: 10.1038/s41586-022-04795-x
Цитаты по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0








