Кардиотоксичность радиотерапии можно преодолеть, воздействуя на сигнальный путь cGAS-STING
В результате радио- и химиотерапии, приводящих к появлению двухцепочечных разрывов ДНК, у пациентов часто развиваются проблемы с сердцем. Исследователи из США на мышиной модели изучили механизм этого явления. У мышей малые молекулы, ингибирующие воспалительный сигнальный путь cGAS-STING, могут предотвратить повреждение сердца.
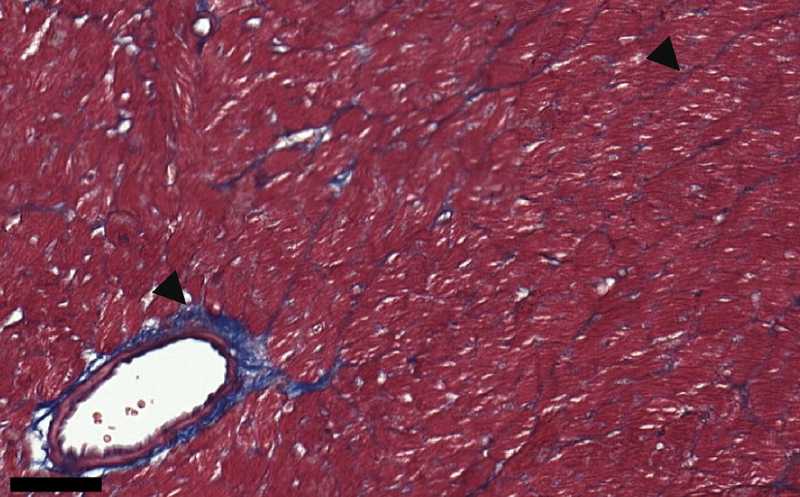
Через шесть месяцев после радиотерапии активация cGAS-STING приводит к фиброзу (синий) сердечной мышцы мыши.
Credit:
© 2022 Shamseddine et al. Originally published in Journal of Experimental Medicine. https://doi.org/10.1084/jem.20220809 | Пресс-релиз
Для лечения онкологических заболеваний очень популярны радиационная терапия и химиотерапия антрациклинами (например, доксорубицином). Такая терапия работает за счет образования двухцепочечных разрывов в ДНК раковых клеток. Однако она же может впоследствии оказывать токсическое действие на сердце. Исследователи из США прояснили механизм кардиотоксичности терапии и предложили пути ее предотвращения.
Мыши получали высокую дозу радиационной терапии, направленной на сердце. Спустя 3–6 месяцев у них развивалась систолическая дисфункция, которую определяли с помощью эхокардиографии. Систолическая дисфункция была ассоциирована с фиброзом. При этом в кардиомиоцитах не было признаков апоптоза ни через 30 часов после радиационной терапии, ни через 28 дней. Схожая картина наблюдается и у пациентов.
Исследователи изолировали кардиомиоциты, эндотелиальные клетки и фибробласты сердца через шесть часов и 28 дней после облучения, после чего секвенировали их РНК. Через шесть часов все виды клеток отвечали примерно одинаково — у них повышалась экспрессия генов, регулируемых p53, которые вовлечены в ответ на повреждение ДНК, регуляцию апоптоза и клеточного цикла. Через 28 дней эти изменения сходили на нет. Наоборот, через 28 дней в фибробластах сердца наблюдался активированный фенотип, ассоциированный с фиброзом. Была повышена экспрессия многих генов коллагена.
В фибробластах сердца через 28 дней также была повышена экспрессия генов, ассоциированных с интрефероновым (IFN) ответом и противовирусным сигналингом, например, Irf7. Авторы сравнили действие радиации и антрациклинов. Они давали мышам доксорубицин в течение пяти недель, а через две недели после завершения терапии изолировали эндотелиальные клетки и фибробласты сердца. Ученые показали, что в фибробластах, но не в эндотелиальных клетках сердца активировался IFN-сигналинг и повышалась экспрессия Irf7.
Авторы изучили механизм такой активации. Множество эндогенных молекул активируют интерфероновый ответ. Радиация и доксорибицин повреждают ДНК, поэтому авторы предположили, что внутриклеточные рецепторы узнают поврежденные нуклеиновые кислоты. И действительно, у мышей, лишенных сигнальных путей, распознающих друхцепочечные ДНК в цитозоле (Cgas−/− и Stinggt/gt), после радиационной терапии не повышалась экспрессия Irf7 и Cxcl10. То же отметили в клетках мышей Stinggt/gt, получавших химиотерапию. Сигнальный путь cGAS-STING — часть системы врожденного иммунитета. Он распознает цитозольную ДНК любого происхождения. Его активация приводит к синтезу IFN I типа и провоспалительных цитокинов.
Секвенировав РНК единичных CD45+ лейкоцитов, изолированных из мышиного сердца, авторы показали, что повреждение ДНК и последующая активация cGAS-STING-сигналинга ремоделируют репертуар лейкоцитов в сердце. Через 28 дней после радиотерапии активированные IFN моноциты и макрофаги, дендритные и B-клетки собираются в сердце Sting+/+ мышей, но не Stinggt/gt. Эти клетки ранее уже связывали с патологическим ремоделированием сердца и фиброзом.
Через три месяца после радиотерапии у мышей дикого типа наблюдались нарушения в работе сердца. Напротив, у мышей Stinggt/gt такой патологии не отмечалось, как не было и признаков фиброза. Это отображает и резкое повышение выживаемости таких мышей через год после терапии. За этот срок от проблем с сердцем погибло 50% мышей дикого типа и 0% мышей Stinggt/gt и Cgas−/−. Схожие результаты показали на животных, которым давали доксорубицин.
Через 28 дней после радиотерапии в крови мышей повышалась концентрация CXCL10. Уровень CXCL10 также был выше у пациентов с начальными признаками кардиотокичности в результате химиотерапии рака молочной железы.
Авторы решили проверить, сможет ли фармакологическое ингибирование сигнального пути cGAS-STING предотвратить развитие кардиотоксичности. Для этого они выбрали малую молекулу, ингибитор STING — H-151. Этот препарат давали мышам дикого типа каждый день, начиная с 21-го дня после радиотерапии. Через 28 дней в фибробластах сердца у таких мышей была ниже экспрессия Irf7 и Cxcl-10. У них также не было признаков кардиотоксичности.
Таким образом, авторы дают следующее объяснение кардиотоксичности некоторых видов терапии онкозаболеваний. Спустя несколько недель после терапии поврежденная ДНК выходит в цитозоль фибробластов сердца. Ее детектирует cGAS, что приводит к активации интерферонового ответа, а потом — к воспалению сердца. Исследователи предполагают, что, таргетируя сигнальный путь cGAS-STING, можно предотвратить повреждение сердца в результате радио- и химиотерапии.
Блокада STING облегчает протекание бокового амиотрофического склероза у мышей
Achraf Shamseddine, et al. Innate immune signaling drives late cardiac toxicity following DNA-damaging cancer therapies // Journal of Experimental Medicine (2022), published December 19, 2022, DOI: 10.1084/jem.20220809


 Меню
Меню





 Все темы
Все темы



 0
0