Клетки рака яичника защищают соседей от химиотерапии с помощью секретируемых компонентов сплайсосом
Рак яичников часто приобретает устойчивость к химиотерапии. Российские исследователи показали, что важную роль в этом играет секретом опухолевых клеток, который меняется в ответ на лечение опухоли препаратами платины. Опухолевые клетки начинают активно секретировать компоненты сплайсосом, которые поглощаются окружающими клетками, и это активирует в них системы репарации ДНК и способствует пролиферации.
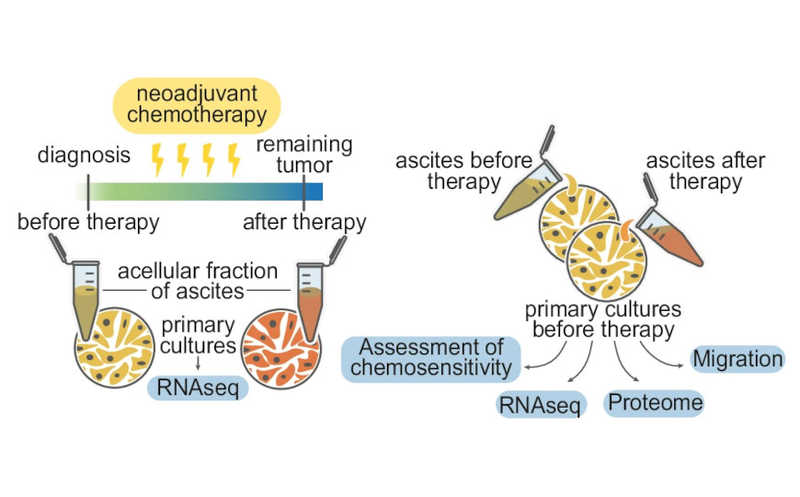
Асциты при раке яичника собирали до и после химиотерапии, чтобы оценить влияние асцитической жидкости на первичные культуры опухолевых клеток, не подвергавшихся действию цисплатина.
Credit:
Nature Communications (2024). DOI:
10.1038/s41467-024-49512-6 |
CC BY
Рак яичников демонстрирует самый высокий уровень смертности среди гинекологических злокачественных опухолей. Как правило, для лечения применяют химиотерапию препаратами платины. Хотя опухоли поначалу отвечают на терапию, впоследствии у них развивается резистентность, приводящая к рецидиву примерно у 80% пациенток. Российские исследователи из Федерального научно-клинического центра физико-химической медицины ФМБА и коллабораторы установили, что устойчивости к цисплатину способствует меняющийся из-за терапии секретом опухолевых клеток.
Авторы статьи, опубликованной в Nature Communications, проанализировали асциты (скопления жидкости в брюшной полости), полученные от одних и тех же пациентов с раком яичника до и после химиотерапии. Асциты разделили на внеклеточную жидкость и опухолевые клетки, которые затем использовали для получения первичных культур. Эти культуры окрашивали на маркеры рака яичников CA125, EpCam и CD44. Как и ожидалось, после химиотерапии опухолевые клетки приобретали устойчивость к цисплатину.
Ранее было показано, что опухолевые клетки, погибающие под действием терапии, способны высвобождать сигнальные молекулы и тем самым снижать эффективность действия терапии на окружающие клетки. Чтобы исследовать роль этого механизма при раке яичников, авторы работы инкубировали первичные культуры клеток, полученные до химиотерапии, с разными вариантами асцитической жидкости. Затем они оценивали чувствительность опухолевых клеток к цисплатину, их миграцию, изменения транскриптома и протеома. Выяснилось, что асцитическая жидкость, собранная после химиотерапии, увеличивает химиорезистентность опухолевых клеток и стимулирует их подвижность. Секвенирование РНК и последующий анализ дифференциальной экспрессии генов выявил, что асцитическая жидкость, полученная после химиотерапии, повышает уровень белков, задействованных в репарации ДНК и регуляции клеточного цикла.
Протеомный анализ выявил более 2 000 белков в асцитической жидкости. При этом в асцитах после химиотерапии происходило обогащение белками рибосом, сплайсосом и протеасом. Дополнительный анализ, в ходе которого состав асцитической жидкости при раке яичника сравнивали с набором белков, обнаруженных в асцитах при циррозе в качестве контроля, выявил 531 белок, который специфично появлялся в асците опухоли после химиотерапии. Функциональная аннотация показала, что эти белки в основном связаны со сплайсингом пре-мРНК.
Сплайсинг пре-мРНК осуществляется сплайсосомой — рибонуклеопротеидным комплексом, содержащим пять некодирующих малых ядерных РНК (мяРНК). Количественная ПЦР с обратной транскрипцией (RT-qPCR) показала повышенный уровень всех мяРНК в асцитической жидкости после химиотерапии. Это вызвало интерес авторов, поскольку сплайсосомные компоненты обычно локализованы внутри клетки.
Внутриклеточные белки могут попадать во внеклеточное пространство двумя путями — при активной секреции либо при гибели клетки. Как правило, во втором случае эти белки обнаруживаются в виде смеси частично деградировавших пептидов. Анализ показал, что большинство пептидов, присутствующих в асцитической жидкости после химиотерапии, происходили от рибосомальных белков. Деградировавших компонентов сплайсосомы при этом не наблюдалось. Когда ученые попытались удалить сплайсосомные рибонуклеопротеины с помощью антител, оказалось, что это удается сделать только при использовании антител к CD63, поверхностному маркеру внеклеточных везикул. Таким образом, именно внеклеточные везикулы отвечают за экспорт сплайсосом.
Затем авторы работы воспроизвели результаты на клеточной модели. Они показали, что секретом клеток рака яичников, обработанных препаратами платины in vitro, повторяет эффект асцитической жидкости, собранной после терапии.
Анализ протеомных профилей секретомов, полученных из различных клеточных линий рака яичников, выявил более высокое разнообразие белков в секретомах после обработки цисплатином. Среди белков, чье содержание увеличилось в секретоме не менее чем в 2 раза, присутствовало много компонентов сплайсосом.
Клетки рака яичника в норме секретировали также различные проонкогенные факторы роста, включая FAM3C, гранулины, фактор роста/дифференцировки 15 (GDF15), факторы роста эндотелия сосудов и другие белки, участвующие в пролиферации, миграции клеток, ангиогенезе и ремоделировании тканей. Под действием цисплатина представленность этих белков в секретоме резко снижалась. В фибробластах, использованных в качестве контроля, наблюдалась обратная картина.
Использование флуоресцентных меток и мечение изотопами методом SILAC выявило транслокацию сплайсосомных белков из ядра в цитоплазму в ответ на обработку цисплатином. Затем эти белки упаковывались во внеклеточные везикулы, а последующее поглощение этих везикул способно существенно повысить уровень белков сплайсосомы в клетках-реципиентах.
Следующим шагом стало изучение молекулярных механизмов, участвующих в переносе компонентов сплайсосом из апоптотических опухолевых клеток в выжившие. Секвенирование РНК и тандемная масс-спектрометрия клеток-реципиентов показали, что секретом от погибающих опухолевых клеток активирует в клетках-реципиентах экспрессию генов, связанных с репарацией ДНК и регуляцией клеточного цикла.
Чтобы подтвердить, что факторы сплайсинга в секретоме способствуют приобретению опухолевыми клетками более агрессивного фенотипа, авторы статьи проанализировали эффект белковых и РНК-компонентов сплайсосомы на опухолевые клетки in vitro и in vivo. В качестве экзогенных сплайсосомных белков выбрали SYNCRIP и SNU13, поскольку они детектировались в секретомах иих уровень возрастал в клетках-реципиентах под действием секретома, а их истощение нарушало репарацию ДНК. Оверэкспрессируя эти белки с помощью лентивирусной системы, ученые показали, что их высокий уровень увеличивал устойчивость клеток рака яичника к цисплатину. И наоборот, нокдаун одного из них способствовал повышению чувствительности клеток к препарату. При этом оверэкспрессия SYNCRIP и SNUI13 повышала в опухолевых клетках уровень компонентов систем репарации ДНК.
Аналогичным образом исследователи проверили, как на устойчивость опухолевых клеток влияют мяРНК. Для дальнейшего анализа выбрали U12 мяРНК, поскольку ее уровень повышался у большинства (7 из 11) пациентов после терапии, и относительное увеличение было наиболее высоким среди всех мяРНК. Также в анализ включили U6atac мяРНК, которая функционирует в комплексе с U12 мяРНК.
Трансфекция клеток SKOV3 и последующее секвенирование РНК через 48 часов после трансфекции показали, что обе анализируемые snRNA вызывали схожие изменения в экспрессии генов, в отличие от контроля (короткий фрагмент мРНК GFP). Функциональная аннотация выявила активацию генов, участвующих в регуляции клеточного цикла, а также в чекпойнт-контроле повреждения ДНК. Этот эффект наблюдался и на белковом уровне, а пролиферация клеток при такой трансфекции усиливалась.
Наконец, ученые проверили влияние экзогенных сплайсосомных мяРНК на прогрессию опухолей. Клетки линии SKOV3 трансфицировали синтетическими U12 мяРНК, U6atac мяРНК или контрольным фрагментом РНК, а затем подкожно вводили клетки иммунодефицитным мышам. Измерение опухоли через 70 дней показало, что обе сплайсосомальные мяРНК значительно ускоряли ее рост.
Таким образом, секретируемые компоненты сплайсосом (белки и мяРНК) воздействуют на такие пути, как репарация ДНК и клеточный цикл, тем самым способствуя пролиферации и выживанию опухолевых клеток. Их секреция при этом активируется во время апоптоза под действием препаратов платины. Понимание роли компонентов сплайсосом в межклеточной коммуникации при терапии может поспособствовать разработке новых стратегий — авторы предполагают, что нацеливание на эти компоненты потенциально способно ограничить резистентность опухолевых клеток.
На вопросы PCR.NEWS ответила Виктория Шендер, зав. лабораторией молекулярной онкологии ФНКЦ ФХМ ФМБА России, первый автор работы.
Некоторые работы демонстрируют, что нарушения сплайсинга также могут обладать онкогенным эффектом. Каким способом можно нацеливаться на компоненты сплайсосом, чтобы избежать риска подобного эффекта?
Существует несколько вариантов воздействия на этот процесс. С одной стороны, ошибки в сплайсинге пре-мРНК можно исправлять с помощью антисмысловых олигонуклеотидов. Однако опухоли весьма гетерогенены, в связи с чем каждое неверное событие сплайсинга заблокировать не удастся. Второй подход основан на глобальном ингибировании или модуляции сплайсинга пре-мРНК с помощью малых молекул, непосредственно связывающихся с белками сплайсосомы или нарушающими их работу. Некоторые из таких соединений, такие как индисулам, H3B-8800 и др., проходили клинические испытания. Мы предполагаем, что комбинация ингибиторов сплайсинга с ДНК-повреждающими агентами может иметь большой терапевтический потенциал. Работы в этом направлении ведутся в нашей лаборатории.
В статье шла речь о том, что было бы интересно исследовать влияние секретомов опухолевых клеток на иммунную систему. Планируете ли вы заняться изучением этого вопроса?
Это исследование о межклеточной коммуникации весьма многогранно и многое еще предстоит выяснить. Помимо компонентов сплайсосомы погибающие опухолевые клетки высвобождают и другие молекулы, которые могут по-разному влиять на другие типы клеток. Мы планируем исследовать коммуникацию между опухолевыми клетками и клетками микроокружения, включая иммунные клетки.
С чем связан тот факт, что секретом обработанных цисплатином опухолей оказывает противоположные эффекты на опухолевые клетки и на нормальные фибробласты?
В организме существует множество компенсаторных молекулярных механизмов, помогающих нормальным клеткам адаптироваться к неблагоприятным условиям и восстанавливать поврежденную ткань. Опухолевые клетки, многократно усиливая те или иные механизмы защиты, используют их для приобретения устойчивости к терапии и быстрого восстановления опухоли после лечения. Замеченное явление также наблюдается в нормальных клетках при определенных условиях, но в значительно меньшей степени. Это можно объяснить тем, что в здоровых клетках все процессы внутреннего гомеостаза строго отрегулированы, такие клетки менее пластичны и избыточные внешние стимулы скорее приведут к гибели нормальной клетки, чем сильно изменят ее состояние. Кроме того, известно, что опухолевые клетки по сравнению с нормальными клетками отличаются повышенной склонностью поглощать внеклеточные везикулы, а также повышенной способностью адаптировать свой фенотип в ответ на изменения микроокружения.
Клетки печени под действием стресса делятся друг с другом ресурсами
Источник
Shender, V.O., et al. Therapy-induced secretion of spliceosomal components mediates pro-survival crosstalk between ovarian cancer cells. // Nat Commun 15, 5237 (2024). DOI: 10.1038/s41467-024-49512-6


 Меню
Меню





 Все темы
Все темы



 0
0