Клетки врожденного иммунитета формируют иммунологическую память
Международная группа ученых исследовала роль клеток врожденного иммунитета в долгосрочной адаптации к патогенным микроорганизмам. Авторы заражали мышей бактерией Citrobacter rodentium, после чего вылечивали их антибиотиками, а через месяц заражали заново. Они показали, что подгруппа врожденных лимфоидных клеток типа 3 персистирует в кишечнике, быстро активируется и защищает мышь от повторного заражения.
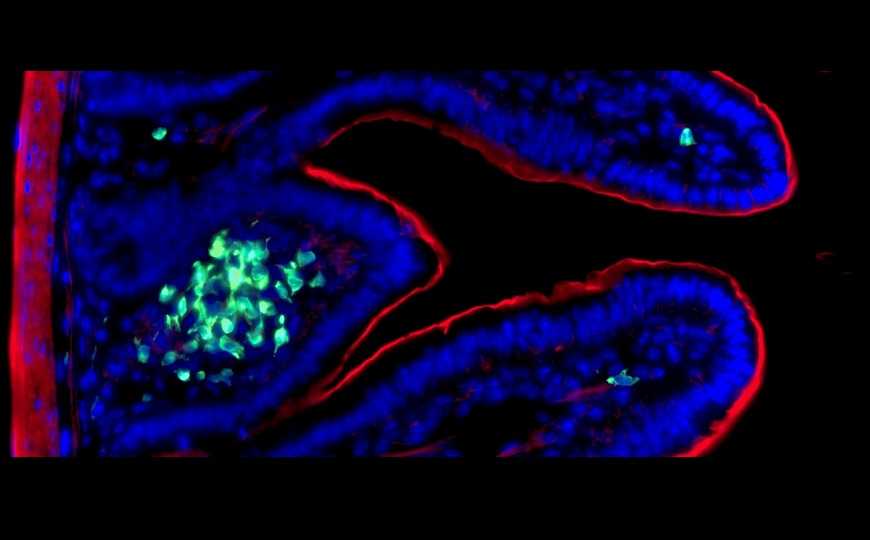
ILC3 обозначены зеленым, ядра — синим, актин — красным.
Credit:
© Nicolas Serafini – Institut Pasteur / Inserm | Пресс-релиз
Слизистая оболочка кишечника обладает сложной системой защиты. Ранний ответ обеспечивает врожденный иммунитет, а долговременную защиту — приобретенный. Однако ученые из Франции, США и Великобритании показали на мышах, что врожденный иммунитет также играет роль в иммунологической памяти.
Врожденные лимфоидные клетки типа 3 (ILC3) в большом количестве присутствуют в кишечнике. При инфекции их активируют IL-1β и IL-23, после чего сами ILC3 вырабатывают IL-17 и IL-22. Клетки также активны во время органогенеза. Их роль в долгосрочной адаптации к патогенным и комменсальным бактериям до сих пор не была показана. Авторы изучали функциональные изменения, которые происходят в ILC3 после встречи с патогенным микроорганизмом.
Ученые заражали мышей Citrobacter rodentium (модель инфекции Escherichia coli у человека). Эта бактерия провоцирует активацию ILC3, а также выработку антиген-специфичных B- и T-клеток. Время заражения и ответ приобретенного иммунитета ограничивали с помощью антибиотиков.
Популяции ILC3 и TH22-клеток оставались стабильными при первоначальной инфекции. Но когда мышь заражали повторно через месяц после получения антибиотиков, уровни NKp46+ и CCR6+ ILC3 быстро возрастали, в то время как число T-клеток не увеличивалось. Тот же эффект продемонстрировали на IL-22-экспрессирующих ILC3 и T-клетках.
После повторного заражения мышей C. rodentium рост патогенных бактерий был подавлен. Авторы предполагают, что возросшая активность ILC3 сыграла роль в развитии резистентности. Также активировались дендритные клетки, но не моноциты, макрофаги или гранулоциты. Взаимодействие ILC3 с патогенными бактериями привело к формированию подгруппы высокоактивных и персистентных клеток, которые авторы назвали «тренированными» (Tr-ILC3).
Общее число ILC3 и IL-22-экспрессирующих ILC3 значительно возрастало у мышей, которых заражали еще через четыре месяца. Авторы показали, что Tr-ILC3 персистируют в кишечнике даже после кратковременного контакта с патогеном; их число повышается при последующих контактах. Защитная активность Tr-ILC3 не зависела от присутствия T-клеток.
Авторы также продемонстрировали повышенный ответ активированных C. rodentium Tr-ILC3 на заражение Listeria monocytogenes. Одни только IL-1β и IL-23 не могли вызвать формирование Tr-ILC3.
РНК-секвенирование показало, что Tr-ILC3 экспрессировали Il22, Il17f, Gzmb и Gzmc на высоком уровне. Также возросла экспрессия генов, связанных с пролиферацией. В клетках произошла глобальная перестройка метаболизма.
Механизм происходящих в Tr-ILC3 процессов остается неизвестным. Эти клетки могут стать новой мишенью для терапии при воспалительных и инфекционных заболеваниях.
Источник
Serafini N., et al. Trained ILC3 responses promote intestinal defense // Science, Vol 375, Issue 6583, pp. 859-863, published February 24, 2022, DOI: 10.1126/science.aaz8777


 Меню
Меню





 Все темы
Все темы




 0
0








