Клей для поджелудочной: как с помощью малой молекулы остановить гибель β-клеток при диабете
Утрата функциональных β-клеток поджелудочной железы — одна из ключевых проблем при диабете 2 типа. Эти клетки погибают в условиях гипергликемии. Международный коллектив ученых проанализировал механизм, вызывающий апоптоз β-клеток при повышенном уровне глюкозы, и предложил способ его заблокировать. Индукция апоптоза связана с транскрипционными факторами ChREBPα и ChREBPβ. Исследователи разработали и оптимизировали «молекулярный клей», который стабилизирует ChREBPα в неактивном состоянии, не давая ему усилить экспрессию ChREBPβ и тем самым вызвать гибель клеток.
Диабет 2 типа — одна из ведущих проблем здравоохранения. В 2021 году им страдали более полумиллиарда жителей Земли, и число пациентов с этим диагнозом продолжает расти. Одна из наиболее важных и до сих пор не решенных проблем в лечении диабета — предотвращение потери функциональных β-клеток, продуцирующих инсулин. Подход к их защите разработали авторы статьи в Nature Communications.
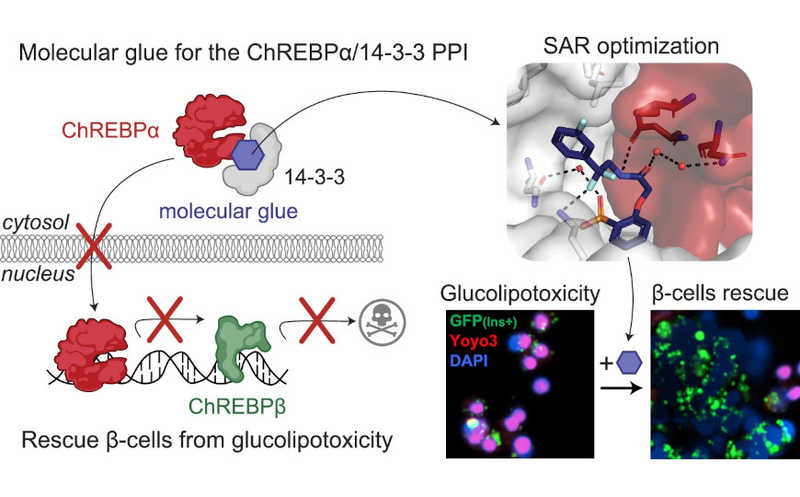
При хронической гипергликемии развивается состояние глюкозотоксичности, связанное с белком ChREBP — реагирующим на глюкозу транскрипционным фактором. Он имеет две изоформы, α и β. При гипергликемии ChREBPα усиливает экспрессию ChREBPβ, а эта изоформа способствует дедифференцировке и гибели инсулинпродуцирующих клеток. (Подробнее об утрате β-клетками зрелого фенотипа — на PCR.NEWS.) Этому препятствует связывание ChREBPα с белками семейства 14-3-3, которое удерживает его в цитоплазме и подавляет активность. В качестве терапевтического подхода ученые предложили стабилизировать это белок-белковое взаимодействие с помощью «молекулярного клея».
Ранее эти же исследователи разработали низкомолекулярные стабилизаторы взаимодействия ChREBPα/14-3-3, однако их активность была ограничена. Чтобы усовершенствовать этот «молекулярный клей» и обеспечить его функциональность в клетке, авторы детально проанализировали связь между структурой и активностью.
ChREBPβ — конститутивно активный фактор транскрипции, связывающий в том числе собственный промотор. Однако он нестабилен при высоких концентрациях глюкозы (время полужизни в таком случае составляет всего 12 минут, тогда как ChREBPα сохраняет стабильность более получаса). Следовательно, без дополнительной активации ChREBPα синтез ChREBPβ должен быть ограничен.
Для проверки гипотезы о том, что удержание ChREBPα в цитозоле будет ингибировать глюкозотоксичность и апоптоз β-клеток, ученые рассмотрели структуру ранее разработанной малой молекулы — она обозначена как стабилизатор 1 — в комплексе с ChREBPα и 14-3-3. По данным рентгеновской кристаллографии и анализа анизотропии флуоресценции они предположили, какие структурные модификации могли бы улучшить работу этой молекулы в клетке. Скрининг библиотеки и последующий анализ структуры позволили получить ряд кандидатных соединений для дальнейшей проверки.
Авторы протестировали шесть соединений (стабилизаторы 1, 12, 30, 43, 53 и 66) на цитотоксичность и способность защищать β-клетки от глюкозотоксичности. Три из них не были токсичны для клеток инсулиномы INS-1, но защищали их от глюкозотоксичности. Концентрации 5 и 10 мкМ заметно снижали гибель β-клеток в условиях гипогликемии, однако значимой пролиферации при этом не наблюдалось. Наиболее перспективным ученые сочли стабилизатор 43 — помимо защиты β-клеток от токсичности, он улучшал индекс глюкозо-стимулированной секреции инсулина (GSIS) и предотвращал пролиферацию, вызванную высоким уровнем глюкозы. Эти эффекты были опосредованы именно ChREBPβ, так как сайленсинг этого белка приводил к аналогичному воздействию, а его оверэкспрессия, напротив, усугубляла глюкозотоксичность и вызывала апоптоз.
Механизм внутриклеточной работы стабилизатора 43 изучили в ходе трех серий экспериментов, посвященных пространственному распределению молекул в клетке и специфичности их взаимодействий. Они показали, что соединение стабилизирует взаимодействие ChREBPα/14-3-3 in situ, предотвращая ядерную транслокацию ChREBPα в ответ на глюкозу.
Затем авторы оценили влияние стабилизатора на транскрипцию ChREBP α и β в островковых клетках поджелудочной железы. Они подтвердили, что экспрессия ChREBPβ возрастала при повышении уровня глюкозы. Стабилизатор 43 предотвращал это повышение экспрессии как на уровне мРНК, так и на уровне белка. Анализ маркеров клеточной идентичности (INS и PDX1) и дедифференцировки β-клеток (ALDH1A3) показал, что стабилизатор поддерживал клетки в дифференцированом состоянии даже при гипергликемии. Кроме того, он замедлял липогенез, препятствуя накоплению церамидов и улучшая функционирование митохондрий.
Авторы утверждают, что созданный ими класс соединений, возможно, представляет собой первый шаг в разработке концептуально новых средств лечения диабета. В более далекой перспективе, подчеркивают они, молекулярный клей может применяться куда шире, в том числе для борьбы с трудноизлечимыми болезнями.
Источник
Katz, L.S., et al. Molecular glues of the regulatory ChREBP/14-3-3 complex protect beta cells from glucolipotoxicity. // Nat Commun 16, 2110 (2025). DOI: 10.1038/s41467-025-57241-7


 Меню
Меню





 Все темы
Все темы




 0
0








