Легочную ткань при COVID-19 разрушает ферроптоз
До сих пор остается неясным механизм разрушительного воздействия коронавируса SARS-CoV-2 на ткани легких. Авторы статьи в Nature Communications пришли к выводу, что гибель клеток происходит в результате ферроптоза, а значит, ингибиторы этого процесса могут оказаться эффективными лекарствами при COVID-19.
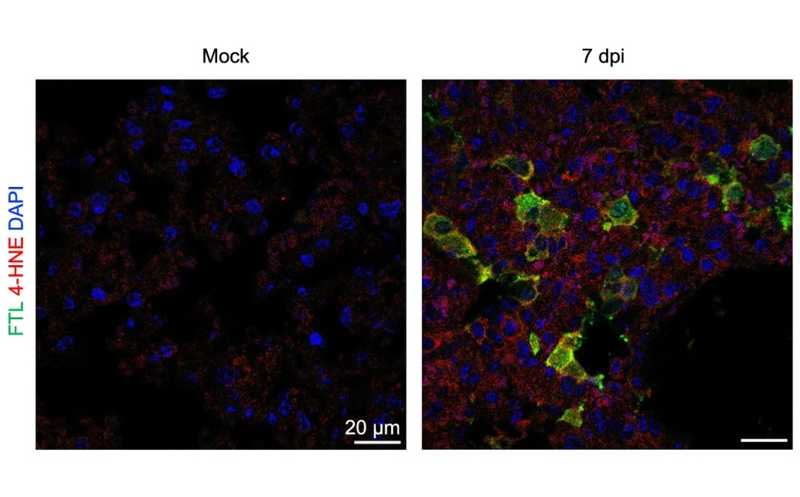
Иммунофлуоресцентное окрашивание ткани легких хомячков, зараженных коронавирусом (справа), и контрольных животных. Уровни 4-гидроксиноненаля (4-HNE, окрашен красным) — конечного продукта перекисного окисления липидов, — а также ферритина (FTL, окрашен зеленым) значительно возрастали при инфекции.
Credit:
Nature Communications, 2024. DOI:
10.1038/s41467-024-48055-0 |
CC BY
Исследователи из Колумбийского университета считают, что основной механизм гибели клеток легких при COVID-19 — это ферроптоз, развивающийся на фоне избыточного накопления железа и, как следствие, смертельного для клетки перекисного окисления липидов и белков.
Ферроптоз был открыт в 2012 году. Причина гибели клеток при ферроптозе – разрушение фосфолипидов в составе клеточных мембран. Есть данные о том, что он может быть одним из процессов, приводящих к нейродегенеративным заболеваниям, а исследования последних лет показали, что ферроптоз можно также использовать для борьбы с раковыми клетками.
Легкие — самый уязвимый орган при COVID-19, что связано как с вирусной инфекцией, так и с воспалительной реакцией на нее, перерастающей в цитокиновый шторм и острый респираторный дистресс-синдром (ОРДС). На гистологическом уровне при ОРДС развивается острое повреждение легких, в том числе диффузное альвеолярное повреждение, при котором наблюдаются отек, образование так называемых гиалиновых мембран и фиброз легочной ткани. При COVID-19 также нередко развивается неострое поражение легочной ткани в виде образования микротромбов в легочных артериолах. Специфического лечения заболевания легких, вызванного коронавирусом, не существует.
Чтобы определить механизмы поражения легких при COVID-19, ученые проводили микроскопическое исследование посмертных образцов тканей легких пациентов с тяжелой формой заболевания. В качестве контроля использовались образцы здоровой легочной ткани, полученные из непораженных участков и при резекции легких с новообразованиями. Еще одна контрольная группа включала образцы легочной ткани, полученные в ходе аутопсии легких пациентов, умерших от ОРДС до пандемии, то есть точно не от коронавируса SARS-CoV-2.
Ткани окрашивали на маркеры, специфичные для ферроптоза (рецептор трансферрина 1 и аддукт малонового диальдегида), некроптоза (фосфорилированная псевдокиназа MLKL), апоптоза (активная форма каспазы 3) и пироптоза (активная форма гасдермина D). Также оценивались показатели ферритина у пациентов с COVID-19 во время госпитализации и ряд других маркеров. Действие коронавируса (штамм SARS-CoV-2-USA-WA1/2020) изучалось на золотых сирийских хомячках и клеточной культуре.
В тканях легких людей с COVID-19 не удалось обнаружить повышения уровня маркеров апоптоза, некроптоза или пироптоза. Основным механизмом гибели клеток легких, пораженных коронавирусом, оказался ферроптоз. На это указывает повышение уровня маркеров ферроптоза в пораженных клетках, в том числе такие процессы, как нарушение регуляции железа, железозависимое перекисное окисление липидов, уменьшение уровня фосфолипидов, содержащих полиненасыщенные ацильные «хвосты», и накопление лизофосфолипидов. Ферроптоз наблюдался при остром и неостром поражении легких, что связано с кровоизлияниями и попаданием в ткани железа из погибших эритроцитов. При тяжелом течении COVID-19 также повышался уровень ферритина в сыворотке крови, что приводило к токсичному нарушению гомеостаза железа в организме.
В частности, накопление лизофосфатидилхолина повышало проницаемость альвеолярного эпителия, приводило к разрушению легочного сурфактанта и активации провоспалительных процессов. Ключевыми антиоксидантами сурфактанта являются плазмалогены, защищающие клетки легких от железозависимого перекисного окисления липидов. При COVID-19 уровень плазмалогенов в пораженных клетках снижался, что усиливало окислительный стресс в тканях. На фоне гидролиза фосфатидилглицеринов, входящих в состав сурфактанта, происходило истощение поверхностно-активных фосфолипидов, накопление жирных кислот и, как следствие, образование гиалиновых мембран при остром поражении легких.
Авторы работы смоделировали коронавирусное поражение легких на хомячках, экспрессирующих рецептор ACE2 — с его помощью вирус SARS-CoV-2 проникает в клетки. Гистологический анализ подтвердил характерное поражение легких, происходившее по механизму ферроптоза. Экспрессия рецептора трансферрина TfR1 коррелировала с тяжестью повреждения легких.
Ингибиторы ферроптоза (аналог ферростатина-1 и липроксстатин-1) уменьшали повреждение легких у зараженных коронавирусом хомячков. Доставка препаратов путем ингаляции обеспечивала высокую биодоступность; увеличить ее также можно с помощью антител и лигандов для нацеливания на заданные типы клеток легких (моноциты, клетки эндотелия). Ученые считают, что решающее значение для лечения COVID-19, а также других опасных коронавирусов (MERS, SARS-CoV-1) будут иметь ингибиторы ферроптоза, а белковые и липидные маркеры ферроптоза могут использоваться для диагностики COVID-19.
Источник
Qiu B., et al. Fatal COVID-19 pulmonary disease involves ferroptosis // Nature Communications. 2024 May 20; 15(1):3816. DOI: 10.1038/s41467-024-48055-0


 Меню
Меню





 Все темы
Все темы




 0
0








