Малярийного плазмодия заставили экспрессировать лишь один вариант белка PfEMP1
PfEMP1 — белок, играющий важную роль в вирулентности малярийного плазмодия. Он отвечает за прикрепление инфицированных эритроцитов к стенкам кровеносных сосудов, что может вызывать тяжелые осложнения. Его изучение было затруднено, так как плазмодии экспрессируют множество вариантов PfEMP1. Авторы нового исследования предложили методику получения паразитов, экспрессирующих только один вариант PfEMP1. С помощью этой методики они изучили транспорт PfEMP1, а также идентифицировали два новых белка, необходимых для цитоадгезии.
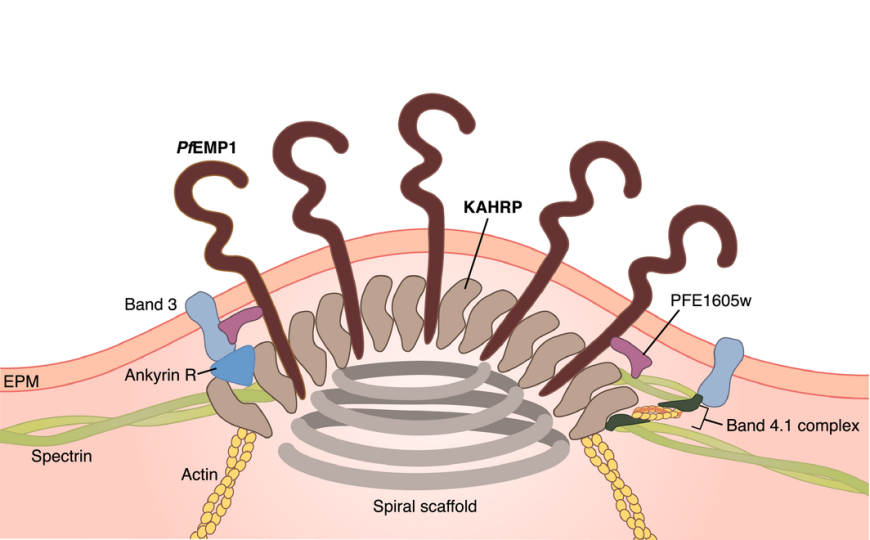
PfEMP1 в мембране эритроцита, инфицированного плазмодием
Credit:
FEBS Letters. 2016. DOI: 10.1002/1873-3468.12142/full | CC BY-SA 4.0
В журнале eLife
опубликован рецензируемый препринт статьи о новом методе изучения PfEMP1 малярийного плазмодия (Plasmodium falciparum). Данное исследование значительно расширяет возможности идентификации белков, задействованных в патогенезе малярии и механизмах уклонения паразита от иммунного ответа.
Белок PfEMP1 (Plasmodium falciparum erythrocyte membrane protein 1) играет ключевую роль в развитии тяжелой малярии. Он экспрессируется на поверхности эритроцитов, инфицированных малярийным плазмодием, и участвует в их цитоадгезии, то есть прикреплении к эндотелию кровеносных сосудов. Цитоадгезия — важнейший механизм выживания и распространения плазмодия, ассоциированный с тяжелыми симптомами болезни, включая церебральную малярию и плацентарную малярию у беременных. Удерживание на эндотелии позволяет его клеткам избегать фильтрации в селезенке, где они обычно уничтожаются, и продолжать размножение в кровотоке, заражая новые эритроциты. (Подробнее о цитоадгезии можно почитать здесь.)
PfEMP1 кодируется генами var, которых в геноме плазмодия от 45 до 90. Каждый паразит в определенный момент экспрессирует только один из этих генов, но может переключаться на другой. Этот процесс, известный как антигенная вариация, обеспечивает изменчивость поверхностных антигенов паразита и помогает ему избегать иммунного контроля хозяина.
Гетерогенная экспрессия генов var у паразитов в клеточных культурах приводит к образованию смешанных популяций клеток с различными антигенными и связывающими свойствами. Хотя ученые пытались отобрать штаммы с более стабильной экспрессией PfEMP1 или использовать антитела для их изучения, эта задача оказалась крайне сложной.
Авторы новой статьи использовали метод, называемый селекционно-связанной интеграцией (SLI). Принцип метода заключается в интеграции специальной плазмиды в геном паразита. Плазмида содержит участок гомологии с концевой последовательностью целевого гена var, участок, кодирующий эпитопную метку для белка, ген саморасщепляющегося пептида и ген устойчивости к антибиотику G418. При трансфекции такой плазмидой клетки паразита, которые экспрессируют целевой вариант PfEMP1 с эпитопной меткой, также обладают резистентностью к G418. После селекции на среде с G418 получаются плазмодии, которые экспрессируют только целевой PfEMP1, несущий удобную для исследований метку.
С помощью этого метода ученые модифицировали линию P. falciparum 3D7. После культивирования и отбора активация желаемых генов var подтверждалась ПЦР и РНК-секвенированием, также наблюдалась экспрессия белка. Однако инфицированные эритроциты не связывались или слабо связывались с рецептором CD36 на эндотелиальных клетках, хотя PfEMP1 присутствовал на клеточной поверхности.
Поэтому исследователи перенесли метод SLI на линиюP. falciparum IT4, который обладает повышенной способностью к цитоадгезии. В плазмодиях этой линии они активировали гены IT4var66 и IT4var2csa так же успешно, как и в случае линии 3D7. VAR2CSA – консервативный вариант PfEMP1, ответственный за связывание с рецептором клеток плаценты CSA (хондроитин сульфат А). Плазмодии, экспрессирующие этот белок, могут вызывать плацентарную малярию — накопление инфицированных эритроцитов в сосудах плаценты нарушает кровообращение и вызывает воспаление, создавая угрозу для здоровья как матери, так и плода.
Линия IT4 с активированным вариантом IT4var2csa продемонстрировала эффективное связывание с декорином и клетками эндотелия головного мозга человека (HBEC-5i), которые экспрессируют CSA. Добавление растворимого CSA ингибировало связывание, что открывает перспективы для разработки препаратов, предотвращающих развитие малярии беременных. В то же время эритроциты, инфицированные IT4var66, связывались только с клетками, экспрессирующими рецептор CD36, но не ICAM-1 (он считается кандидатом на роль рецептора адгезии хозяина при церебральной малярии) и не с контрольными клетками, экспрессирующими флуоресцентный белок GFP.
После этого авторы провели серию экспериментов, в которых показали, что транспорт PfEMP1 зависит от белкового комплекса PTEX.
Пвторы также представили усовершенствованную версию метода SLI — SLI2, которая позволяет вносить дополнительные изменения в геном паразитов, уже несущих модификацию SLI. С помощью SLI2 они получили плазмодиев, экспрессирующих PfEMP1, слитый с биотин-протеинлигазой BirA*, что позволило применять метод BioID для идентификации белков, взаимодействующих с PfEMP1. Это привело к созданию проксиома PfEMP1 — списка белков, которые находятся в непосредственной близости от PfEMP1 в живых паразитах.
В проксиом вошли многие известные участники транспорта PfEMP1, а также ранее неизвестные, такие как TryThrA и EMPIC3. Методом SLI2 исследователи нарушили функцию генов, кодирующих эти белки. Оказалось, что TryThrA и EMPIC3 необходимы для цитоадгезии, опосредованной PfEMP1. У паразитов с нарушенной функцией TryThrA наблюдалась аномальная локализация PfEMP1, в то время как паразиты с нарушенной функцией EMPIC3 сохраняли типичную локализацию PfEMP1.
Таким образом, SLI и SLI2 — мощные инструменты для изучения PfEMP1, которые позволяют достичь более глубокого понимания механизмов патогенеза малярии и разработать новые подходы к ее лечению и профилактике.
Резистентных к артемизинину возбудителей малярии выявили у детей с тяжелой формой заболевания
Источник
Cronshagen J., et al. A system for functional studies of the major virulence factor of malaria parasites // eLife 13, RP103542 (2024) DOI: 10.7554/eLife.103542.1


 Меню
Меню





 Все темы
Все темы




 0
0