Малые молекулы помогают разрушить фермент, защищающий раковые клетки от иммунного ответа
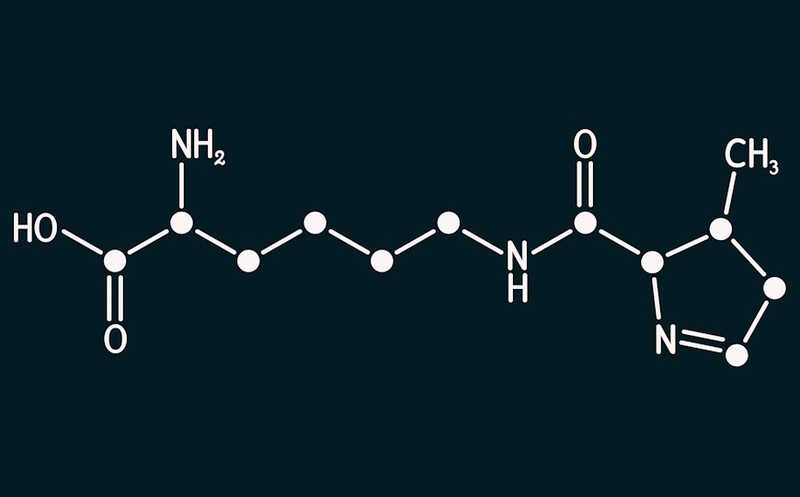
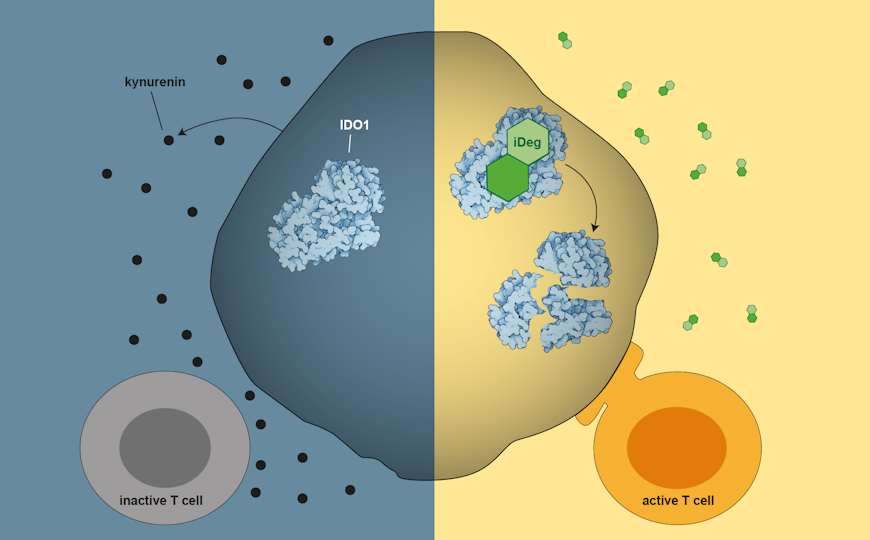
IDO1 — фермент метаболизма триптофана, позволяющий раковым клеткам уклониться от иммунного ответа. Ингибиторы этого фермента не имели успеха в клинических испытаниях, вероятно, из-за дополнительных сигнальных функций IDO1. Авторы статьи в Nature Chemistry предложили решить эту проблему при помощи направленной деградации белка. Они описали класс малых молекул, которые усиливают убиквитинзависимую деградацию IDO1, то есть активируют естественный механизм его удаления из клетки. Эти соединения, названные iDeg, снижали общий уровень белка, а не только его ферментативную активность, и ослабляли способность раковых клеток к миграции in vitro.
Credit:
MPI MOPH | пресс-релиз
Направленная деградация белков — один из способов вмешательства в их работу, не требующий прямого ингибирования активности. Авторы статьи в Nature Chemistry применили его к IDO1 — ферменту, который участвует в уклонении раковых клеток от иммунного ответа. Его ингибиторы рассматривали как способ повысить эффективность лечения опухолей, однако подход ограничен тем, что белок обладает также неферментативной сигнальной функцией. Это ограничение можно устранить направленной деградацией IDO1, и ученые описали класс молекул-деструкторов, обладающих уникальным механизмом действия и нацеленных на этот фермент.
Индоламин-2,3-диоксигеназа 1 (IDO1) — один из ключевых ферментов кинуренинового пути метаболизма триптофана. Этот путь играет важную роль в подавлении активности иммунной системы. Экспрессия IDO1 уже описана в различных типах раковых опухолей, и имеющиеся данные указывают на роль этого фермента в злокачественной трансформации. В частности, высокий уровень IDO1 связан со снижением противоопухолевого иммунного ответа и худшим прогнозом.
Ученые проанализировали библиотеку из более чем 150 тысяч малых молекул, чтобы выяснить, какие из соединений влияют на уровень кинуренина — продукта ферментативной активности IDO1. Экспрессию IDO1 в клетках авторы стимулировали интерфероном гамма (IFN-γ). Скрининг in vitro выявил производное (−)-миртанола, которое ингибировало синтез кинуренина. Полумаксимальная ингибирующая концентрация (IC50) составила 0,83 ± 0,31 мкМ, соединение обозначили как iDeg-1.
При этом iDeg-1 слабо влиял на ферментативную активность IDO1, его транскрипцию или трансляцию. Однако он дозозависимо снижал уровни этого белка. Дальнейшие эксперименты на клеточной культуре выявили, что iDeg-1 индуцирует убиквитинирование IDO1, а через 24 часа после обработки значимо снижается уровень этого белка. Ингибитор протеасомы карфилзомиб препятствовал деградации, что подтверждает роль убиквитин-протеасомной системы в механизме действия iDeg-1.
IDO1 связывает гем в качестве кофактора и существует в клетке в двух формах — апо- и голофермента (то есть без гема и с ним). Спектроскопия в УФ и видимом спектре показала, что в присутствии iDeg-1 или его аналогов, обозначенных как iDeg-2 и iDeg-3, пик голо-IDO1 уменьшается. Иными словами, iDeg конкурируют с молекулами гема за связывание с ферментом. Данные структурного анализа указывают на то, что iDeg меняют конформацию C-концевой области IDO1, которая играет роль в деградации. и повышают в ней доступность сайтов убиквитинирования,
Поиск E3-убиквитинлигазы, участвующей в деградации IDO1, ученые провели с помощью CRISPR-скрининга. Библиотека гидовых РНК была нацелена на 1301 убиквитин-ассоциированный ген. Как и ожидалось, нокаут субъединиц протеасомы блокировал эффект iDeg. Ключевым для деградации IDO1 оказался комплекс куллин-RING-лигазы, содержащий CUL2 и KLHDC3 и обозначаемый как CRL2KLHDC3.
Сам по себе нокаут этого комплекса менял скорость деградации IDO1 даже в отсутствие iDeg. Однако при обработке этими соединениями эффект был более выраженным, и авторы предположили, что iDeg усиливают деградацию IDO1 по естественному механизму.
Белок KLHDC3 в составе CRL-комплекса распознает C-дегроны, то есть C-концевые последовательности, которые помечают белок для протеасомной деградации. Авторы проверили, служит ли IDO1 прямым субстратом этого распознающего белка — для этого они восстановили убиквитинирование на биохимическом уровне. Также они провели эксперименты на клетках с мутациями в последовательности дегрона IDO1. Результаты подтвердили, что IDO1 является прямым субстратом комплекса CRL2KLHDC3, и что рецепторный белок в составе этого комплекса распознает именно C-концевой дегрон.
Затем исследователи провели несколько конкурентных анализов, по результатам которых предложили модель внутриклеточной регуляции IDO1. Согласно этой модели, синтезированный de novo IDO1, не связавшийся с гемом, быстро удаляется из клеток путем убиквитинзависимой деградации. В присутствии гема в клетке формируется пул голо-IDO1, способный избежать деградации.
Наконец, авторы убедились, что iDeg могут ингибировать неферментативную проопухолевую функцию IDO1. Это подтвердили на культуре раковых клеток SKOV3 — их способность к миграции снижалась при обработке одним из iDeg, как и при нокауте IDO1.
Благодаря своему механизму действия, iDeg снижают уровень IDO1 и, в отличие от классических ингибиторов, нарушают все функции этого белка. Авторы предполагают, что именно неферментативные функции белка могут объяснять неэффективность ингибиторов IDO1 в клинической практике, и поэтому считают iDeg перспективными для дальнейшей разработки подходов к терапии рака.
Малая молекула активирует железо в лизосомах раковых клеток и запускает ферроптоз
Источник
Hennes, E., et al. Monovalent pseudo-natural products supercharge degradation of IDO1 by its native E3 KLHDC3. // Nat. Chem. (2026). DOI: 10.1038/s41557-025-02021-5


 Меню
Меню





 Все темы
Все темы



 0
0