МД-2023: Стандартизация и регуляторика
Какие документы регламентируют лабораторные исследования (и кстати, как называется в российских регуляторных документах диагностика point-of-care?), как работает система межлабораторных сличений результатов, что нужно учитывать, чтобы обеспечить высокое качество молекулярно-генетических исследований в онкологии, и почему лабораторно разработанные тесты не являются «незарегистрированными».

Ольга Тарасенко
Фото:
Денис Зыбин
Спикеры секции «Качество, безопасность и эффективность молекулярной диагностики» на конференции «Молекулярная диагностика 2023» обсуждали регуляторные вопросы, решение которых необходимо для успешной трансляции научных разработок в практику.
Ольга Тарасенко (ФГБУ «ВНИИИМТ» Росздравнадзора, председатель Технического комитета 380 «Клинические лабораторные исследования и диагностические тест-системы ин витро») в своем докладе «Вопросы стандартизации и технического регулирования лабораторных исследований и медицинских изделий для молекулярной диагностики» сделала обзор документов, регламентирующих практически все аспекты внедрения и применения технологий молекулярной диагностики.
Работы по стандартизации в России регламентируются федеральными законами № 184-ФЗ от 27 декабря 2002 года и от № 162-ФЗ 29 июня 2015 года. Во втором из них приведен перечень документов по стандартизации и требования к ним. Ключевые принципы стандартизации — добровольность применения документов, обеспечение комплексности, системности, открытость разработки документов стандартизации и достижение консенсуса среди специалистов. Технические условия тоже могут иметь права стандарта, подчеркнула докладчица, если их регистрируют в Фонде национальных стандартов. Это уже не просто документ производителя, а национальный документ стандартизации.

ГОСТами регулируются, в частности, преаналитический этап, организация деятельности лабораторий и качество лабораторных исследований (в том числе меры по снижению ошибок), требования к безопасности, медицинские изделия для in vitro диагностики и порядок их применения. Есть ГОСТы для молекулярной диагностики и для микробиологических исследований. ГОСТ Р 57175-2016 включает требования к ПЦР-наборам и исследованиям с применением ПЦР.
В состав Технического комитета380 (ТК 380) входят представители самых разных ведомств и ведущих производителей. Стандартов разрабатывается много, но про них знают в основном испытательные лаборатории, остальные знают меньше, а это очень удобный формат документов, отметила докладчица. Минздрав РФ фактически не имеет права на разработку методик и правил, тогда как стандарты — это национальные документы, которые становятся обязательными, если ссылки на них появляются в приказах Минздрава или вводятся внутренними документами.
Планируется выпуск сборников стандартов и статей экспертов по различным направлениям. Впервые получил аккредитацию испытательный центр для пластика (проверка на наличие ДНК и РНК, ДНКазы и РНКазы и проч.)
Ольга Анатольевна обратила внимание на отдельные модернизированные стандарты, например, ГОСТ Р 59787-2021/ISO/TS 20658:2017 — требования к взятию, транспортировке и обработке биоматериала, измененные для повышения безопасности. Первого мая 2024 года вступит в силу ГОСТ, посвященный преаналитическим этапам исследований метаболомики мочи, сыворотки и плазмы венозной крови. Завершается работа над важным стандартом 15189 о частных требованиям к качеству и компетентности для работы медицинских лабораторий.
Среди ГОСТов, посвященных организации работы лаборатории, докладчица обратила особое внимание на документы, касающиеся исследований по месту лечения и исследований по месту нахождения пациента (ИМНП — то, что часто называют point-of-care или «у постели больного»). Это необходимо, поскольку появляются мобильные приборы и тест-системы для таких анализов.
Что касается качества лабораторных исследований, ожидается постановление правительства по производству «стандартных образцов» — контрольных материалов, соответствующих установленным требованиям.
ГОСТ 15190, посвященный безопасности, — «стандарт, по которому можно и нужно работать», сказала Ольга Анатольевна. Там не будет подробного описания каждой мелочи, но прописаны основные подходы к обеспечению безопасности.
Есть две группы медицинских изделий для диагностики in vitro. Первая группа — изделия для исследования биоматериалов человека, которые регистрируются Росздравнадзором. Вторую группу не очень удачно называют «незарегистрированные медицинские изделия» — те, которые разрабатываются в медорганизации, применяются только в ней и нигде больше. Но эти продукты также должны получать разрешение, поэтому «негативное» название им не подходит. Лучше называть их «лабораторно разработанные тесты» (англ. lab developed tests, LDT).
Затем Ольга Анатольевна коснулась некоторых особых категорий изделий. Например, к «немедицинским изделиям, применяемым в медорганизации» относятся самые разные предметы, от банкетки до чашки Петри и центрифуги. Питательные среды и реагенты, которое Роспотребнадзор использует, например, для исследования распространенности клещевых инфекций, не могут быть медизделиями для диагностики in vitro, так как исследования не проводятся на биоматериале человека. Но они могут называться просто медицинскими изделиями.
Идет работа над такими понятиями, как медизделия для прогностических или предиктивных исследований. «Диагностика» на самом деле довольно узкий термин. Так, положительный результат теста на COVID-19 позволяет поставить диагноз, но, к примеру, определения уровней креатинина и мочевины в крови для постановки диагноза недостаточно, такой анализ является вспомогательным. По скрининговому тесту на гепатит В диагноз не ставится, по подтверждающему, который выполняется в случае положительного скринингового, — ставится. Сейчас появляются понятийные аппараты, которые охватывают все применения стремительно развивающейся молекулярной диагностики, в том числе и новые, недавно появившиеся, подчеркнула докладчица.
Создается новая группа стандартов — по методам исследований в медицинских лабораториях (таких, как исследование качества спермы). Этот документ компактен и прост для понимания, в отличие от ВОЗовского руководства, в нем есть место и производителю, и ожиданиям профессионального сообщества. То же самое можно сделать и по другим заболеваниям.
Помимо ГОСТов, Ольга Тарасенко показала на слайдах перечень документов некоммерческой международной организации Global Laboratory Standards for a Healthier World, посвященных молекулярной диагностике.
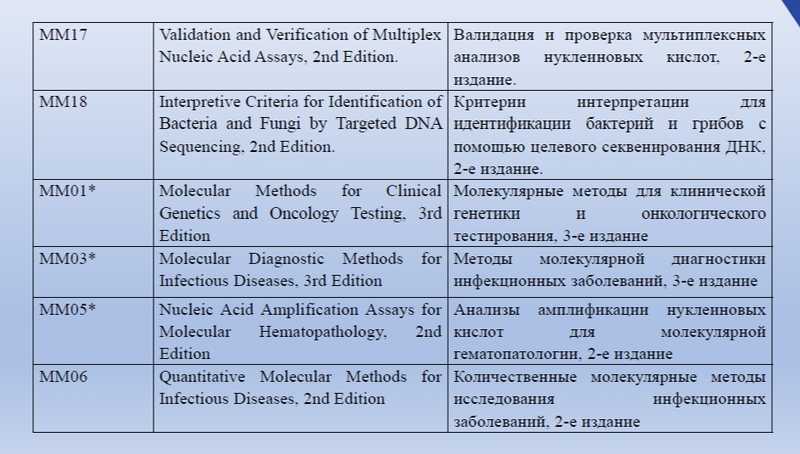
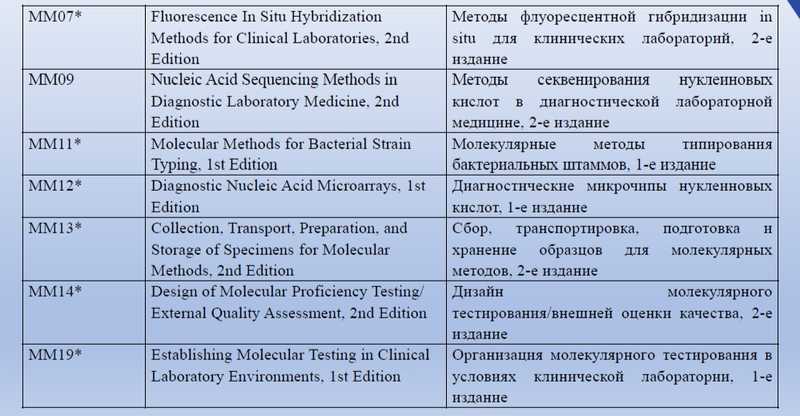
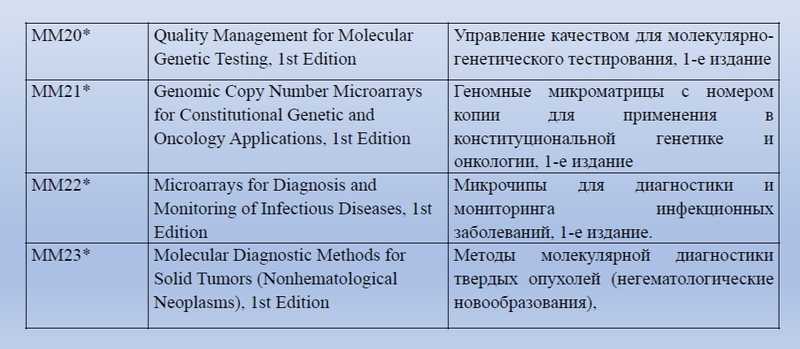
Внедрение в РФ международных стандартов молекулярных методов анализа будет большим подспорьем. Также в планах ТК 380 — стандарт, обеспечивающий качество лабораторно разработанных тестов.
О других нерешенных вопросах говорили во время дискуссии после доклада. Например, одноразовые маски и домашние тесты во время вспышек COVID-19 и других респираторных заболеваний в медицинских учреждениях утилизируются по строгим правилам, но очевидно, что большинство пользователей у себя дома просто бросают их в мусорное ведро, и с этим трудно что-то сделать.
Владимир Малахов (АСНП «Центр внешнего контроля качества клинических лабораторных исследований») — один из основоположников системы межлабораторных сличений результатов молекулярно-диагностических исследований в медицинских лабораториях в системе ФСВОК. Усилия по созданию систем внешней оценки качества (ВОК) на федеральном уровне начали предприниматься еще в 1990-х годах, объяснил он. В 2021 году вышел приказ Минздрава №464н «Об утверждении Правил проведения лабораторных исследований». Согласно Правилам и ГОСТ Р ИСО 151189-2015, регулярное участия в программах сличительных испытаний является обязательным для лабораторий.
В настоящее время в МСИ ФСВОК входит 215 программ, охватывающих различные направления исследований. В том числе существует 13 программ по количественному и качественному определению нуклеиновых кислот патогенов методом ПЦР, в каждой из них участвуют сотни лабораторий. В последние два года появились программы по генетическим исследованиям (болезнь Жильбера, диагностика лактазной недостаточности, муковисцидоза, тромбофилии, молекулярно-генетические исследования в онкологии, выявление аллеля HLA-B*27 локуса В главного комплекса гистосовместимости).
Каждый год участникам рассылаются контрольные образцы (согласно требованиям безопасности, они не содержат способных к размножению патогенов), которые исследуются так же, как образцы пациентов.
В качестве примера Владимир Николаевич показал, как менялась доля неудовлетворительных результатов при выявлении ДНК вируса гепатитов В и С и ВИЧ (а также ДНК человека в образце).
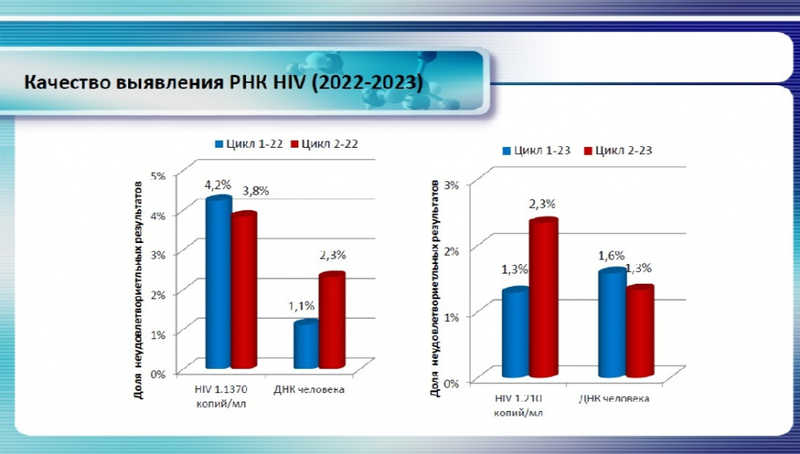
Большинство ошибок происходит на преаналитическом и постаналитическом этапе, где значительную роль играет человеческий фактор. С 2024 года начнут оцениваться и эти этапы.
Общее число участников программ по оценке качества ПЦР-исследований растет, их уже более 900. По В последние два года улучшается специфичность выявления ДНК и РНК, чувствительность на прежнем уровне (95–98%).
Отвечая на вопросы слушателей, Владимир Малахов признал, что у системы ФСВОК есть «задолженность» перед лабораторным сообществом в отношении публикаций, в которых были бы представлены полученные результаты.
Очень информативным был доклад Владимира Назарова (Научно-методический центр по молекулярной медицине Минздрава России ПСПбГМУ им. академика И.П. Павлова, Санкт-Петербург). Он рассказал об особенностях работы с ДНК при молекулярно-генетической диагностике наследственных заболеваний и при онкологических состояниях.
Онкогентика стремительно развивается, во всем мире тестов выполняется все больше.
При этом исследуется очень широкое разнообразие образцов. Это не только кровь и моча, но и цитологический материал, и блоки FFPE, и нативная ткань. Необходимо выявлять широкий спектр изменений в ДНК, и сама ДНК может содержать необычные повреждения и модификации. Другие аналитические особенности, осложняющие задачу исследователя, — наличие псевдогенов, GC-насыщенные регионы; исследование хотспотов или полной последовательности требует различных подходов. Есть и постаналитические проблемы: связи генотипа и фенотипа в онкологии сложны, врачи-клиницисты должны обладать достаточными навыками, чтобы понимать, что они получили. В этой ситуации контроль качества особенно важен, и его невозможно правильно организовать без понимания всех особенностей молекулярно-генетических исследований в онкологии.
Ключевые этапы — это выбор материала для анализа, метода выделения и метода исследования ДНК.
В образцах крови высоко содержание ДНК, она имеет высокое качество. Слюна и мазки чаще используются для «рекреационной» генетики, они содержат мало ДНК и могут быть контаминированы бактериями. Цитологические образцы (например, раки щитовидной железы) имеют низкую концентрацию таргетной ДНК, но позволяют оценить количество опухолевых клеток до исследования. Такую же возможность дают и блоки FFPE (фиксация формалином, заливка парафином), но проблемы исследования нуклеиновых кислот в этих образцах хорошо известны. Минус нативных тканей — невозможность контроля контаминации другими тканями. Наконец, исследование циркулирующей ДНК из плазмы (не клеток) крови требует сложной преаналитической подготовки.
Капиллярная кровь в сухом пятне, так, как ее сохраняют во время неонатального скрининга, плохо подходит для определения аналитов с возможной низкой копийностью, но преимущество таких образцов — возможность хранения при комнатной температуре. Концентрацию НК можно повысить с помощью настройки протокола; докладчик и его коллеги работали с подобными образцами.
Выбор материала до некоторой степени определяет подход к выделению ДНК. Каждый из методов имеет плюсы и минусы, однако классический фенол-хлороформ, несмотря на хорошее качество ДНК, Владимир Дмитриевич призвал не использовать из-за высокого уровня токсичности и низкого уровня гендерного и возрастного разнообразия в лабораториях: «девушкам не надо с ними работать».
Важный этап — оценка концентрации ДНК. Спектрофотометрия, по опыту докладчика, из-за свободных нуклеотидов существенно завышает цифры (до 6 раз!) в сравнении с более точными флуориметрией и количественной ПЦР. Минус флуориметрии в том, что она требует расходных материалов, а кПЦР сложна для рутины и занимает много времени.
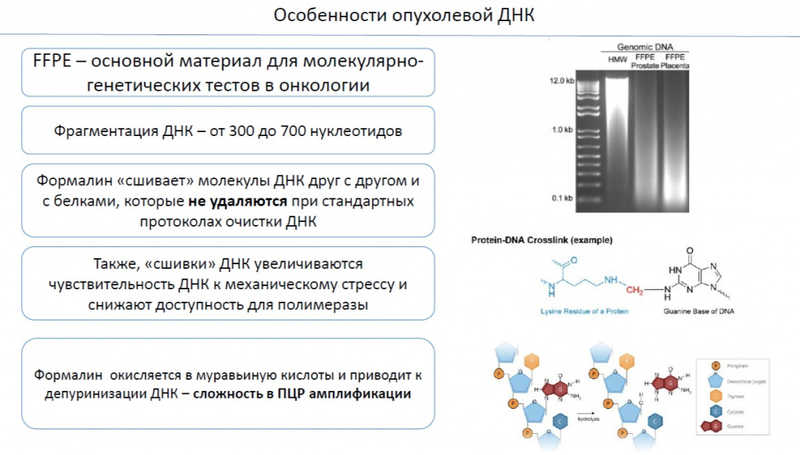
FFPE — основной материал молекулярно-генетических исследований в онкологии, но очень проблемный. ДНК сильно фрагментирована (300–700 нуклеотидов), из-за сшивок ПЦР может не проходить. Окисление формалина в муравьиную кислоту приводит к депуринизации ДНК. что затрудняет ПЦР-амплификацию. Владимир Дмитриевич перечислил оптимальные для анализа ДНК условия фиксации, которых следует придерживаться при подготовке материала, — 10%-ный формалин, не более 1 дня, не более25 °С. С каждым лишним днем фиксации качество ПЦР ухудшается.
Наконец, сама ДНК в высоких концентрациях может быть ингибирующим агентом при ПЦР. исследователи интуитивно научились разводить библиотеку вдвое, после чего реакция проходит.
Нет идеального метода для выявления всех изменений в геноме опухолевой клетки, подчеркнул докладчик. Несмотря на «лоббирование» NGS и веру клиницистов в его возможности, оно не выявляет экспансии, протяженные дупликации и делеции.
Также существуют особые изменения ДНК с клиническим значением — например, псевдогены (нефункциональные гены, не кодирующие нормального белка), которых описано более 20 тысяч. Псевдогены усложняют выявление истинных патогенных вариантов. Это касается таких патологий, как наследственный панкреатит, врожденная гиперплазия надпочечников, болезнь фон Виллебранда, недостаточность протеина S, аутосомно-доминантная поликистозная болезнь почек и другие. Но пути решения есть: например, проведение двух циклов ПЦР (в первом амплифицируется целевой ген, во втором проводится стандартная ПЦР на ампликоне) или использование праймеров к специфическим регионам целевого гена.
В конце доклада Владимир Назаров поделился опытом проведения внешнего контроля качества молекулярно-генетических исследований (выявления соматических мутаций в генах BRAF, EGFR, KRAS).
Валерий Полуновский (MyGenetics) рассказал о российском lab developed tests (LDT) и о том, как регулируется применение этих «незарегистрированных» медизделий для диагностики in vitro. Такие тесты, как объясняла Ольга Анатольевна Тарасенко в первом докладе, могут применяться в той же организации, в которой они разработаны, при условии получения соответствующего разрешения.
Компания MyGenetics, резидент Сколкова и Технопарка новосибирского Академгородка, разрабатывает ДНК-тесты для превентивной и персонализированной медицины, с 2017 года проводит генетические исследования мазков буккального эпителия. Сейчас у компании есть 24 генетических панели для оценки предрасположенности к мультифакторным заболеваниям.

Докладчик поделился пошаговым опытом получения одобрения LDT в России и опытом его использования в клинической практике. В России пока всего три компании прошли этот путь.
Все начинается с подготовки технической документации, рекомендованной экспертным советом. Необходимы внутрилабораторная инструкция по применению, зарегистрированный отчет НИОКР, предоставление необходимых материалов и сведений в Росздравнадзор для экспертизы, оценка работоспособности и проверка документации экспертным советом. Вместо регистрационного удостоверения лабораторно разработанный тест получает выписку из реестра выданных разрешений на использование в медицинских целях.
Продукт Metabolic Kit предназначен для определения полиморфизмов в 60 локусах ДНК методом ПЦР и оценке их влияния на метаболизм.
На базе Metabolic Kit была создана линейка отдельных продуктов для выявления маркеров риска заболеваний, сказал Валерий. «Незарегистрированные» тест-системы не могут поступать в продажу, но внутри лаборатории-разработчика могут использоваться в медицинских целях. Пути коммерциализации разработки – программы ДМС, ОМС, предложение услуги через сетевые лаборатории, а также дополнительные платные услуги.
Информация о докладчиках
Тарасенко Ольга Анатольевна, заместитель генерального директора ФГБУ «ВНИИИМТ» Росздравнадзора, председатель Технического комитета 380 «Клинические лабораторные исследования и диагностические тест-системы ин витро»
Малахов Владимир Николаевич, директор провайдера «Ассоциация специалистов некоммерческое партнерство «Центр внешнего контроля качества клинических лабораторных исследований» (АСНП «ЦВКК»)
Назаров Владимир Дмитриевич, к.м.н., врач клинической лабораторной диагностики, лабораторный генетик, Научно-методический центр по молекулярной медицине Минздрава России ПСПбГМУ им. академика И.П. Павлова
Полуновский Валерий Владимирович, руководитель отдела разработки MyGenetics


 Меню
Меню





 Все темы
Все темы




 0
0