МД-2023: Репродукция человека
В природе лишь каждое четвертое оплодотворение яйцеклетки приводит к рождению живого ребенка. И у тех, кто родился, вероятность генетических нарушений не так мала, как представляется неспециалистам, особенно в группах риска. Преконцепционное тестирование (на этапе планирования беременности) может быть приемлемым даже для очень религиозных родителей, но до его повсеместного внедрения еще далеко. На секции «Репродукция человека. Молекулярно-генетические аспекты» обсуждались подходы к пренатальному тестированию и организации скрининга, преимплантационное тестирование и многое другое.

Секцию открыл доклад Игоря Лебедева (НИИ медицинской генетики, Томский НИМЦ РАН) о методах хромосомного микроматричного анализа, полногеномного и полноэкзомного секвенирования в идентификации причин ранней эмбриолетальности и невынашивания беременности.
Всего 25% случаев оплодотворения яйцеклетки заканчиваются рождением живого ребенка; 15% беременностей — это клинически распознаваемые спонтанные аборты, 30% случаев — ранние репродуктивные потери, возможно, не всегда замеченные самой женщиной, и наконец, 30% случаев — преимплантационные потери.
Изучение эмбриолетальности началось в 1970-е годы, когда была опубликована статья Лайонела Пенроуза и Джой Деланти о хромосомных аномалиях (они обуславливают 50% случаев невынашивания).

Однако у традиционного цитогенетического анализа достаточно много ограничений — низкая эффективность культивирования, контаминация материнскими клетками, нестабильность генома, хромосомный мозаицизм. В современной диагностике его дополняют геномные и цитогеномные технологии, такие как флуоресцентная in situ гибридизация (FISH), сравнительная геномная гибридизация (CGH), в том числе в формате микроматричного анализа (aCGH).
Хромосомный микроматричный анализ (ХМА) — тест первой линии при выявлении хромосомных аномалий. Он позволяет выявить аномалии в том числе у спонтанных абортусов с нормальным кариотипом
Основной источник информации о хромосомном мозаицизме — преимплантационное генетическое тестирование на анеуплоидии (ПГТ-А). В 2018 году было показано, что для неинвазивного тестирования на анеуплоидии можно использовать внеклеточную ДНК эмбриона вместо клеток бластоцисты; такой подход может помочь избежать и недовыявления мозаицизма. Кроме того, Игорь Николаевич рассказал об удивительном явлении — рождении здоровых детей после переноса мозаичных эмбрионов; вероятно, коррекция хромосомных нарушений происходит в результате селекции клонов. Возникает вопрос, насколько хорошо мы понимаем механизмы коррекции хромосомных нарушений, существующие в природе. Одна из статей, посвященных клиническому случаю развития здорового ребенка из эмбриона, первоначально не рекомендованного к переносу, называется «Порядок из хаоса».
Отсюда не стоит делать вывод, что тестирование на кариотип перед переносом эмбриона не нужно. Достоверно показано, что мозаичность снижает число имплантаций и наступления беременности (хотя она все-таки наступает в 30% случаев), увеличивает частоту спонтанных выкидышей. Тем не менее есть подкатегории мозаичных эмбрионов с относительно высокой вероятностью успеха.
Цитогенетике прерывания беременности в первом триместре посвящена статья Игоря Николаевича с коллегами, которая только что вышла в Nature Medicine. В работе участвовали ученые из Нидерландов, России и Эстонии.
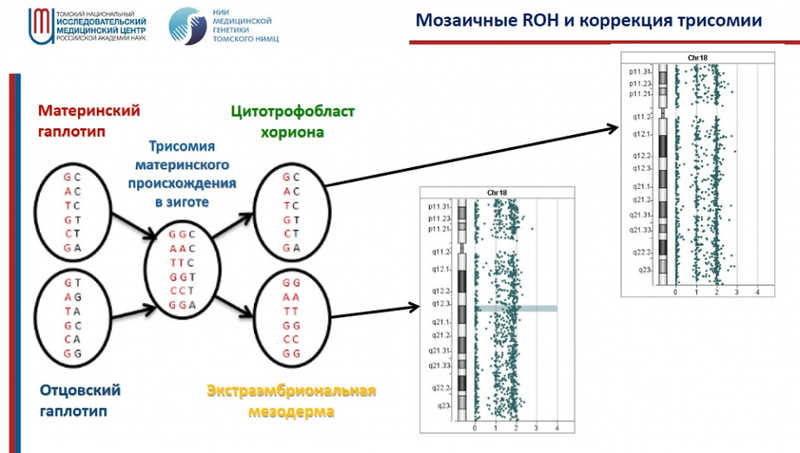
Авторы исследовали 1745 спонтанных абортусов и обнаружили, что примерно половина (50,4%) были кариотипически аномальными, причем частоту хромосомных аберраций увеличивал как возраст матери, так и возраст отца. Затем для 94 абортусов с нормальными кариотипами провели генотипирование родительской ДНК, ДНК экстраэмбриональной мезодермы и ворсинок хориона. Оказалось, что если в жизнеспособных эмбрионах мозаичные хромосомные аномалии часто ограничиваются ворсинками хориона, то при спонтанных прерываниях анеуплоидии накапливаются в экстраэмбриональной мезодерме. В результате у 35% эмбрионов удалось выявить хромосомные аберрации, не обнаруженные классическим тестом кариотипирования; пересчет на всю исследуемую группу позволяет предположить, что частота потерь беременности из-за хромосомных аберраций в ней могла достигать 67,8%.
В той же логике проводятся дальнейшие исследования: выявление у спонтанных абортусов с нормальным кариотипом мозаичных вариаций числа копий (CNV), мозаичных регионов гомозиготности. Как выяснилось, эти аномалии тоже тканеспецифичны. Предполагается, что регионы гомозиготности могут возникать как раз при коррекции хромосомных нарушений, например трисомии.
Опубликованы десятки работ по экзомному и геномному секвенированию при невынашивании беременности. Однако диагностическая ценность этих подходов сильно варьирует, так как для понимания значимости вариантов нужны базы данных — без них непонятно, какую роль играет тот или иной обнаруженный вариант.
Так или иначе, ясно, что для эмбриональных геномов характерен высокий уровень геномной нестабильности; самокоррекция кариотипа при мозаицизме нуждается в дальнейшем изучении.
Около 15% супружеских пар сталкиваются с проблемой бесплодия, напомнил Вячеслав Борисович Черных (МГНЦ им. академика Н.П. Бочкова). Его доклад был посвящен экзомному и геномному секвенированию в диагностике генетических форм мужского и женского бесплодия. Такие формы часто проявляются малым количеством или отсутствием гамет (в этих случаях говорят о синдромальных гаметопатиях — «болезнях половых клеток») и обычно плохо поддаются лечению.
За генетические формы мужского и женского бесплодия отвечают более 2–3 тысяч генов, причем многие не имеют специфического фенотипа. Генетическими причинами нарушения репродукции могут быть как герминативные мутации, так и соматические, и мутации в половых клетках. Не менее 1% мужчин из общей популяции страдают генетически обусловленным бесплодием. Генетические формы мужского бесплодия изучены лучше, так как женское бесплодие сложнее изучать. Однако, например, гены синаптонемного комплекса вовлечены в развитие как мужского, так и женского бесплодия. Преждевременная недостаточность яичников — гетерогенное заболевание; генетическую причину удается выявить у 2—25% пациенток, и это могут быть как хромосомные аномалии, так и генные мутации или варианты генов, и эпигенетические факторы (аномалии инактивации Х-хромосомы).
Цель современных методов геномного анализа — установить причину бесплодия, дать пациенту прогноз и рекомендации. Вячеслав Борисович рассказал о нескольких редких случаях в своей практике. Например, у пациентки в возрасте 31 года с нормальным кариотипом были ооциты низкого качества, не удавалось провести ЭКО. Причиной оказалась ранее не описанная мутация в экзоне 4 гена тубулина бета класса 8 (TUBB8), нарушающая созревание ооцитов.
Известны десятки «болезней половых клеток», имеющих генетические причины. Так, цилиарные дискинезии (потеря функции жгутиков и ресничек) возникают в результате мутаций в генах белков аксонемного аппарата.
Полноэкзомное секвенирование позволяет выявить патогенные или вероятно патогенные варианты у лиц с бесплодием неизвестной этиологии. Например, докладчик с коллегами исследовали семью из Таджикистана: два брата из трех бесплодны, у третьего, фертильного, был сын с situs inversus viscerum. Это состояние часто ассоциировано с первичной цилиарной дискинезией, и действительно, у пациента с необструктивной азооспермией была обнаружена мутация в CCDC103 (ген ключевого белка сборки внешних динеиновых ручек аксонемы). Но кроме того, у него обнаружилась редкая мутация в гене SCR2 пероксисомного фермента для расщепления и внутриклеточного транспорта жирных кислот с разветвленной цепью. Таких пациентов известно мало, подчеркнул докладчик, возможно, всего трое. У двух других развились тяжелые патологии, пациент, обследованные в МГНЦ, жаловался только на бесплодие, но признаки патологии мозга у него имелись.
Секвенирование генома или экзома следует назначать в отобранных клинических группах, отметил Вячеслав Борисович; неэффективно назначение для любых пациентов с бесплодием. Тем не менее он предложил слушателям направлять в лабораторию генетики нарушения репродукции своих пациентов с бесплодием неясного происхождения.
Гоносомные аномалии, то есть аномалии хромосом половых клеток, и нарушение формирования пола (НФП) были темой доклада Натальи Вячеславовны Опариной (МГНЦ им. академика Н.П. Бочкова, ФГБНУ «РНЦХ им. Б.В. Петровского). Гоносомы играют ведущую роль в нарушении формирования пола, включая такие состояния, как синдром Шерешевского–Тернера (45,Х), синдром Клайнфельтера (47,XXY). Аномалии гоносом формируют широкий спектр фенотипов, от почти бессимптомных до крайне тяжелых форм.
На результат исследования сильно влияет мозаицизм, довольно широко распространенный при гоносомных аномалиях (в тканях индивида присутствуют две или более клеточных линии с различными наборами половых хромосом). Наталья Вячеславовна привела в качестве примера случай девочки с синдромом Шерешевского–Тернера, у которой в клеточной линии лимфоцитов сравнительно редко встречался кариотип, соответствующий заболеванию, а в клетках буккального эпителия он преобладал. По данным докладчицы и соавторов, из 85 человек высокая и экстремально высокая межтканевая вариабельность клеточных линий наблюдалась у 44%, а низкая — лишь у 36%. Об этом необходимо помнить при обследовании.
Когда мозаицизма нет, результаты различных методов хорошо соотносятся друг с другом, но когда он есть, возможно сильное расхождение. Выбор метода тестирования очень важен; и стандартное цитологическое исследование (СЦИ), и FISH, и хромосомный микроматричный анализ (CGH) имеют как плюсы, так и минусы.
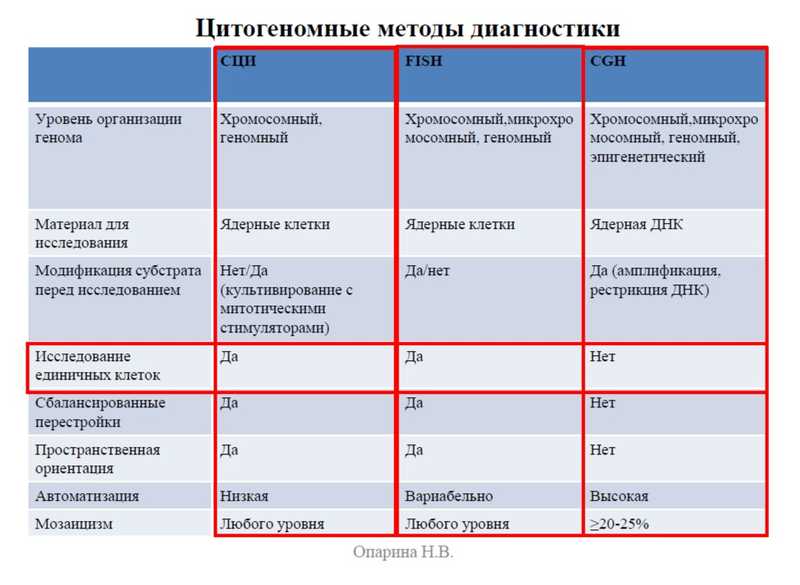
Геномные методы позволяют уйти от субъективизма, но когда они становятся тестами первой линии, при поиске гоносомных аномалий могут быть проблемы. Наталья Вячеславовна описала несколько случаев, когда молекулярные методы ошибочно определяли хромосомные перестройки.
При любых формах тестом первой линии должен быть НФП кариотип, подчеркнула докладчица, но чтобы увидеть полную картину и сделать прогнозы, необходим комплекс методов. СЦИ корректно описывает все присутствующие клеточные линии при мозаичном кариотипе, FISH позволяет оценить истинное соотношение линий, дает более точную информацю о структурных перестройках, хромосомный матричный анализ уточняет точки разрыва и выявляет микрохромосомные перестройки. Врач-генетик должен быть ведущей фигурой в ходе исследования, подчеркнула Наталья Вячеславовна, тем, кто разрабатывает стратегию, аккумулирует и интерпретирует результаты.
О пренатальной диагностике хромосомных заболеваний — «от зачатия до родов» — рассказала Ольга Викторовна Малышева (НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта). Анализов делается все больше, используются разные методы — НИПТ, биопсия хориона, амниоцентез, кордоцентез. И, к сожалению, иногда у одного и того же пациента получаются разные результаты. Это связано не только с мозаицизмом: у всех методов есть ограничения.
Ольга Викторовна особо подчеркнула, что доля эмбрионов с анеуплоидиями, по данным ПГТ-А, неизбежно увеличивается с возрастом матери; об этом должны помнить все специалисты.
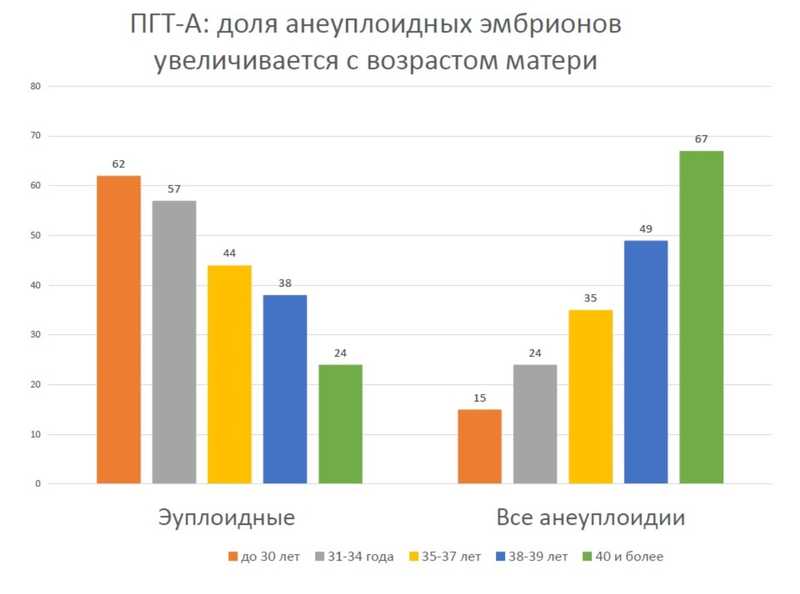
При ПГТ-А не всегда удается исключить хромосомные аномалии (в том числе из-за мозаицизма). Докладчица описала случаи, когда после ЭКО плод останавливался в развитии и хромосомный микроматричный анализ выявлял делецию или транслокацию, пропущенную ПГТ-А. Как показывает анализ материала замерших беременностей, до 50–60% эмбрионов имеют хромосомные аномалии; выявление их важно для диагностики последующих беременностей.
К неинвазивным методам относятся комбинированный скрининг первого триместра (КС1) и НИПТ. КС1 делается всем беременным по ОМС, НИПТ — по желанию (показания еще нуждаются в стандартизации). НИПТ может быть полногеномным и таргетным. Ограничение НИПТ — чувствительность от 5 млн п.н., ошибки, связанные с мозаицизмом у плода и матери, синдромом исчезнувшего близнеца. Бывают случаи, когда высокий риск делеции подтверждается хромосомным матричным анализом на амниоцитах. А бывает и хороший результат НИПТ при явных маркерах патологии на УЗИ. Инвазивная пренатальная диагностика тоже не исключает ошибок. Следует помнить, что ни один отдельно взятый нормальный результат пренатальной диагностики не исключает полностью хромосомную патологию плода.
О преконцепционном скрининге (у супружеских пар при планировании беременности) рассказала Юлия Насыхова (НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта). По некоторым оценкам, существует более 9 тысяч наследственных заболеваний, и далеко не для всех есть лечение. В России сейчас живет около 3 млн человек с наследственными и врожденными заболеваниями; наследственные патологии имеют 5–7% новорожденных. Единственный способ уменьшить популяционный генетический груз — это профилактика, а преконцепционный скрининг – самый эффективный подход.
Скрининг можно организовать так, что он будет приемлемым даже для глубоко религиозных людей. Например, в Израиле есть национальная программа, в которой участвуют ультраортодоксальные евреи: обследование проходят школьники, а результат анализируется при планировании свадеб. Перечень заболеваний для анализа устанавливается с учетом этнической принадлежности пары, так как Израиль – многонациональная страна. В Австралии действует программа «Миссия Маккензи», в которой участвовало более 8 тысяч пар; обследование проводится на 750 заболеваний. В Саудовской Аравии обязателен добрачный скрининг на серповидноклеточную анемию и талассемию.
Для преконцепционного скрининга используются как генотипирование, так и секвенирование, и комбинация методов.
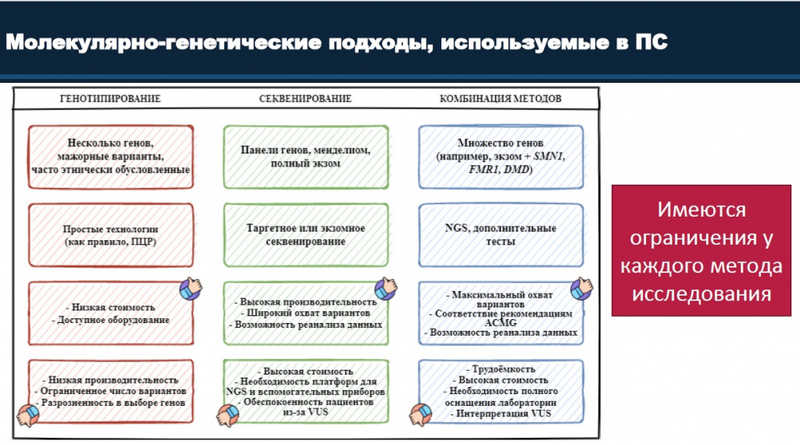
Юлия Алмазовна поделилась своим опытом организации пилотного проекта по преконцепционному скринингу российских пар из групп риска по муковисцидозу, фенилкетонурии и спинальной мышечной атрофии. В рамках госзадания планируется программа, в которой будут участвовать 200 супружеских пар без известных рисков.

Критериями включения было заболевание или носительство у одного из супругов либо у родственников первой или второй степени родства. Информацию о проекте распространяли через соцсети, сообщества пациентов, родительские чаты и т.п. Также проводится социологическое исследование востребованности подобных программ среди общей популяции.
На данный момент в проекте участвуют 17 семей (для 8 анализ выполнен, 9 в работе).Юлия Алмазовна отметила низкую информированность и заинтересованность участников, в особенности будущих отцов, многие из которых даже не изъявляли желания сами побеседовать с врачом, а «делегировали» эту обязанность жене. У части родственников с заболеванием не было необходимых выписок, не удавалось узнать, что за мутация. Сложно оформить транспорт биоматериала из других населенных пунктов. Поэтому многие пациенты отказываются от участия или же прекращают контакты после получения «хороших» анализов. Некоторые пациенты-носители не понимают, что вероятность рождения больного ребенка 25% — это высокий риск.
В ходе второго пилотного проекта, для общей популяции, планируется разработка диагностической панели для выявления патогенных вариантов моногенных заболеваний, разработка тест-систем для преимплантационного генетического тестирования на моногенные заболевания (ПГТ-М), алгоритма комплексного генетического обследования. Приглашают к участию пары, которые планируют беременность. Нужна именно расширенная диагностическая панель, включающая генетические заболевания, наиболее частые у различных народов, подчеркнула докладчица. Это позволит исключить стигматизацию и дискриминацию.
Еще один особый случай, с которым могут столкнуться репродуктивные генетики, -- асимметричная активация Х-хромосомы. Обычно Х-хромосомы в организме девочки инактивируются рандомно, в соотношении 50:50, но встречаются и отклонения, которые могут быть вызваны мутациями в генах инактивации или более сложными причинами. Елизавета Фонова (НИИ медицинской генетики, Томский НИМЦ РАН) рассказала об исследовании Х-сцепленных CNV и асимметричной инактивации Х-хромосомы при невынашивании беременности.
Если в общей популяции асимметричная инактивация встречается в 3,6% случаев, то при носительстве мутаций в генах Х-сцепленных форм умственной отсталости — уже в 50%, у женщин с умственной отсталостью — в 7,6% случаев, у спонтанных абортусов с нормальным женским кариотипом —в 7–15% случаев.
Понятно, что асимметричная инактивация может влиять на фенотипический эффект Х-сцепленных мутации, он проявляется сильнее или слабее. Целью исследования Елизаветы Алексеевны и ее коллег было определение роли инактивации Х-хромосомы в проявлении микроделеций и микродупликаций при нарушении эмбрионального развития и невынашивании беременности. Исследовали женщин с невынашиванием беременности и без этого диагноза, спонтанные абортусы и медицинские абортусы. В первых трех группах удалось обнаружить асимметричную Х-инактивацию. Следующими этапами было исключение мутаций в генах XIST и XAST (они кодируют РНК и играют ключевую роль в инактивации), поиск патогенных CNV и определение статуса метилирования Х-хромосомы в регионах делеций. Авторы разработали алгоритм диагностики микроструктурных перестроек на Х-хромосоме в семьях с невынашиванием беременности (которые могли быть незаметными из-за асимметрии Х-инактивации у матери).
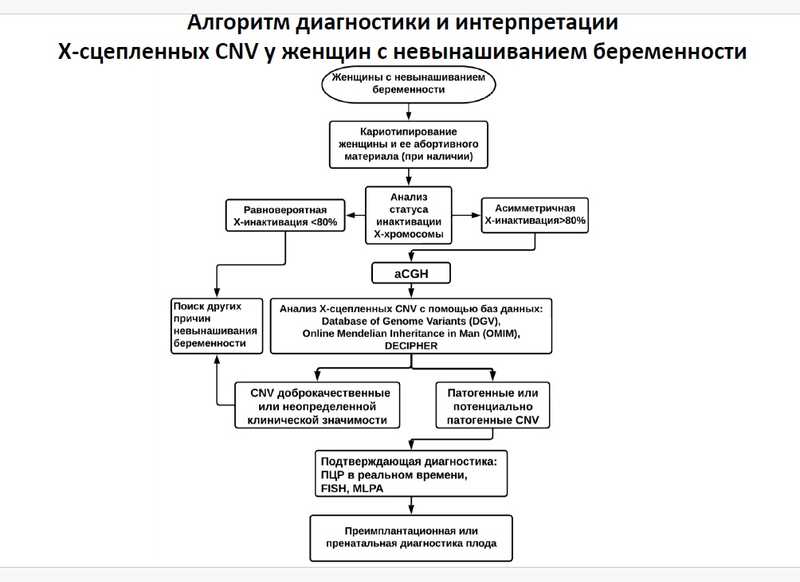
Действительно, частота асимметричной инактивации была повышена у женщин с невынашиванием (6,7% против 2,2% у женщин без проблем с репродукцией), а также у женщин с нормальным кариотипом и спонтанными прерываниями беременности.
Доклад Ильи Баркова (НМИЦ АГП им. В.И. Кулакова Минздрава России) назывался «От НИПТ к НИПС: перспективы пренатальной диагностики».
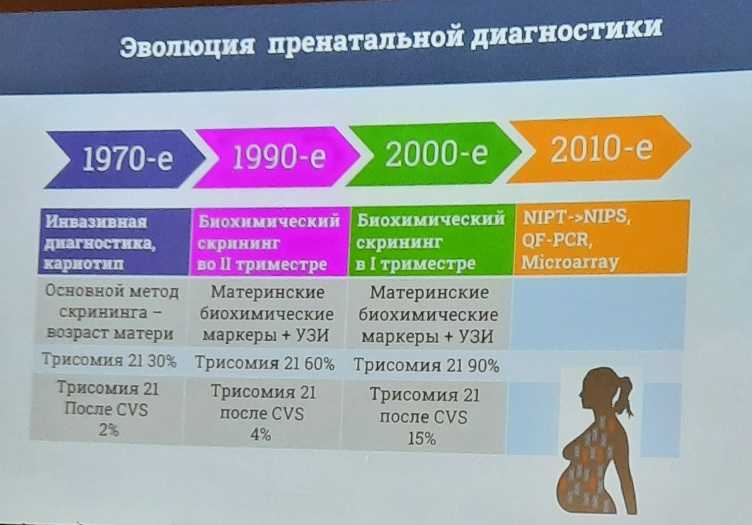
Неинвазивное пренатальное тестирование полезно при правильном применении. Однако многие пациентки воспринимают результат НИПТ как окончательный диагноз, иногда решают прервать беременность при «плохом» результате. Необходимо понимать, что положительный результат НИПТ не равняется диагнозу и нуждается в подтверждении.
В отдельных странах НИПТ внедряется в широкую практику как тест «первой линии» или скрининговый тест. В Нидерландах это были программы TRIDENT-1 и TRIDENT-2: в 2014 году начали тестировать беременных высокого риска, а с 2017 года — всех беременных (1500 образцов в неделю), причем женщины могли выбирать между ДНК-скринингом и скринингом первого триместра, заранее оговаривать объем информации, которую хотят или не хотят получить, а также получали консультацию специалиста. Эти программы выявили ряд проблем, в частности, рост числа инвазивных процедур при использовании полногеномного подхода, стресс у беременных, высокие требования к квалификации консультанта, который встречается с редкими вариантами.
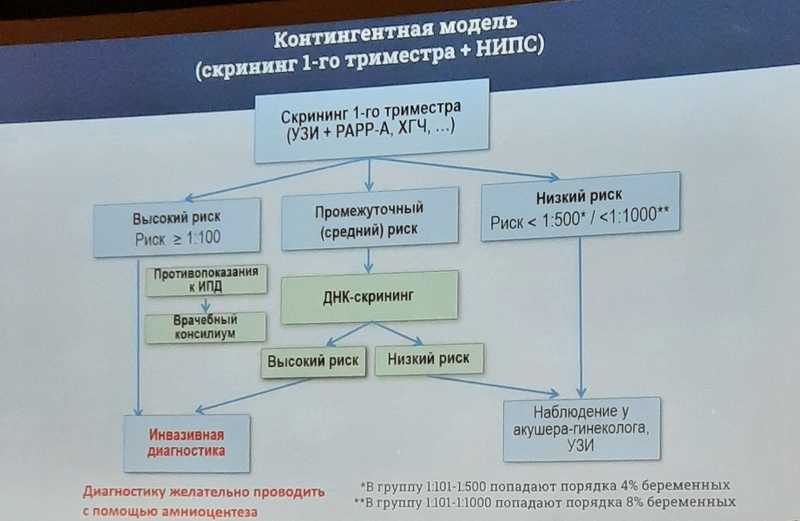
Контингентная модель (сочетание НИПТ и скрининга первого триместра) в 2010-е годы была внедрена во многих европейских странах. В России предлагалась следующая модель контингентного пренатального скрининга на хромосомные аномалии: введение НИПТ на наиболее частые трисомии (хромосомы 21, 18 и 13) в группе среднего риска, сформированной по результатам раннего пренатального скрининга, и затем инвазивная пренатальная диагностика всем беременным из группы высокого риска по раннему скринингу, а также беременным с положительными результатами НИПТ из группы среднего риска и с неинформативными результатами НИПТ.
Илья Юрьевич отметил сложности, сопряженные с полногеномным вариантом неинвазивного скрининга. В частности, чем более редкие находки появляются, тем сложнее консультирование, возникает нехватка квалифицированных врачей. Есть сложности при валидации результата по биоматериалу плода; прерывание беременности по медицинским показаниям при подтвержденных хромосомных аномалиях в РФ рекомендовано до 22 недель, на более поздних сроках уже необходимо собирать консилиум. Трисомию по хромосоме 21 успешно и быстро выявляют с помощью количественной флуоресцентной ПЦР QF-PCR (выполняется разделение аллельных вариантов STR).
Российские клинические рекомендации уже используют понятие неинвазивного пренатального скрининга анеуплоидий плода методом секвенирования ДНК в крови матери, подчеркнул докладчик.
С учетом высокой стоимости НИПС оптимальным в настоящее время является контингентный скрининг — сочетание НИПС и комбинированного скрининга первого триместра, включающего УЗИ и биохимические маркеры патологий. Для подтверждающей диагностики с помощью инвазивного скрининга предпочтительнее амниоцентез, чем биопсия хориона. Экспресс-методы (QF-PCR) помогут обеспечить оперативность. Финансирование НИПС может осуществляться из региональных бюджетов. Необходимо, однако, чтобы скрининг первого триместра проводился на должном уровне, — условие, которое выполняется далеко не везде в России.
Завершил секцию доклад Елизаветы Мусатовой (Центр генетики и репродуктивной медицины «Генетико») о преимплантационном генетическом тестировании (ПГТ) моногенных заболеваний.

В «Генетико» разработаны тест-системы более чем для 90 моногенных заболеваний, 278 семей прошли ПГТ-М, более 1400 эмбрионов проанализировано. Большинство семей имеют аутосомно-рецессивную патологию. К сожалению, чаще всего семьи узнают о риске, когда больной ребенок уже родился или есть больной родственник, преконцепционный скрининг — единичные случаи.
Елизавета Валерьевна перечислила ключевые подготовительные этапы ПГТ-М и возможные узкие места. Например, недостаточно образцов ДНК только будущих родителей; после анализа родословной врач-генетик решит, чей биоматериал будет нужен. Эмбрионы должны быть получены в достаточном количестве, чтобы можно было выбрать эмбрион без патогенных мутаций, между тем из-за возраста или индивидуальных особенностей родителей это не всегда достижимо. Для анализа нужна биопсия трофэктодермы, и эмбриолог должен владеть этой техникой; при этом морфологические характеристики не всегда эмбриона позволяют выполнить биопсию. Прямая диагностика — не идеальный метод; малое количество и деградация материала может привести к дропауту (потере) аллеля. Поэтому косвенная диагностика — анализ ДНК будущих родителей, больного ребенка, гаплотипирование и т.д. — необходима. Далее, несмотря на все усилия, не всегда удается получить непораженные эмбрионы.
Врачам-генетикам приходится решать сложные этические вопросы, если пара настаивает на переносе эмбриона с патогенной мутацией или если при обследовании обнаружен аллель, связанный с тяжелой патологией, такой как болезнь Гентингтона, о которой будущие родители не знают.
Бывает, что пара просит о переносе аномальных эмбрионов (например, с наследственной онкопатологией), это влечет не только этические, но и правовые последствия. Докладчица рассказала о ситуации, когда были получены эмбрионы с патогенным вариантом BRCA1; в этом случае риск меньше для эмбрионов мужского пола, но эти эмбрионы оказались девочками, и ввиду высокого риска рекомендации дать было нельзя. Клиника может сама выбрать политику по согласию и отказу от переноса эмбриона с положительными результатами ПГТ-М, и с ней надо ознакомить клиентов заранее, подчеркнула Елизавета Валерьевна.
Особый случай — «сиблинги-спасители»: проведение ЭКО с целью рождения ребенка, который бы мог стать донором для брата или сестры. Докладчица рассказала о собственном опыте сотрудников «Генетико»: у шестилетней девочки с анемией Швахмана–Даймонда родился HLA-идентичный брат, и девочке выполнили трансплантацию гемопоэтических стволовых клеток (ГСК) пуповинной крови и костного мозга, что привело к полному восстановлению гемопоэза. Пациентка больше не зависел от переливания крови и имела нормальные показатели крови через 160 дней после трансплантации, сообщается в статье.

Но был и другой случай: семья с запросом на ПГТ-М по поводу АД-поликистоза почек запросила также HLA-типирование и сохранение ГСК для помощи старшему сиблингу; родители также планировали возможную пересадку почки. При этом нет данных об успешном лечении поликистоза пересадкой ГСК и не ведется подобных экспериментов; донором органа может стать только взрослый человек, и для пересадки почки совпадение HLA необязательно. Семья продолжала настаивать, но после заседания этического комитета получила отказ в HLA-типировании (ПГТ-М на поликистоз почек было выполнено).
В заключение Елизавета Мусатова рассказала о возможных причинах ложных результатов. Причины могут быть как биологическими (мозаицизм, анеуплоидии, рекомбинация, ОРД), так и техническими (малое количество образца, предпочтительная амплификация и выпадение аллеля, деградация ДНК, контаминация, ошибки интерпретации). Ошибки возможны, но редки при применении адекватных подходов. Важна косвенная диагностика. «У нас нет данных о расхождении ПГТ-М и пренатальной/постнатальной диагностики», — подчеркнула докладчица.
Информация о докладчиках
Лебедев Игорь Николаевич, к.б.н., руководитель лаборатории онтогенетики, зам. директора по научной работе НИИ медицинской генетики Томского НИМЦ РАН
Черных Вячеслав Борисович, д.м.н., заведующий лабораторией генетики нарушения репродукции, ФГБНУ «Медико-генетический научный центр им. Н.П. Бочкова», Москва
Опарина Наталья Вячеславовна, врач – лабораторный генетик, заведующая лабораторией цитогенетики МГНЦ им. академика Н.П. Бочкова, врач – лабораторный генетик лаборатории медицинской генетики ФГБНУ «РНЦХ им. Б.В. Петровского»
Малышева Ольга Викторовна, к.б.н., с.н.с. отдела геномной медицины им. В.С. Баранова, НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта, Санкт-Петербург
Насыхова Юлия Алмазовна, к.м.н., зав. лаборатории геномики с группой биоресурсной коллекции НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта, Санкт-Петербург
Фонова Елизавета Алексеевна, м.н.с. лаборатории онтогенетики НИИ медицинской генетики Томского НИМЦ РАН
Барков Илья Юрьевич, зав. лабораторией пренатального скрининга НМИЦ акушерства, гинекологии и перинатологии им. В.И. Кулакова Минздрава России, Москва
Мусатова Елизавета Валерьевна, к.м.н., врач-генетик, ПГТ-консультант, врач-лабораторный генетик, Центр генетики и репродуктивной медицины «Генетико», Москва


 Меню
Меню





 Все темы
Все темы




 0
0