МД-2023: Папилломавирус и рак шейки матки
Сможет ли человечество победить рак шейки матки и что для этого необходимо, обсуждали на секции «Молекулярные методы в диагностике и эпидемиологии папилломавирусной инфекции». В России рекомендован охват скринингом 80% женщин, но на практике до этого результата нам еще очень далеко. Также пока нет собственной вакцины, а вот хорошие отечественные тест-системы для выявления вируса папилломы человека — есть.
Подавляющее большинство случаев рака шейки матки (РШМ) ассоциировано с инфекцией онкогенными подтипами вирусом папилломы человека (ВПЧ). Согласно глобальной стратегии Всемирной организации здравоохранения ВОЗ «90-70-90», 90 % девочек к 15 годам должны быть вакцинированы против ВПЧ, не менее 70 % женщин должны пройти скрининг на основе высокоэффективного теста и 90 % больных с предраком и инвазивным раком должны получать лечение. По оценкам ВОЗ, это позволит снизить заболеваемость до 4 случаев на 100 тысяч женщин в год. О перспективах внедрения ВПЧ-теста в программы скрининга в России рассказала председатель секции Ольга Шипулина (АО «Лабквест»).
ВОЗ рекомендует регулярный скрининг на ДНК ВПЧ женщинам с 30 лет, Американское онкологическое общество — с 25 лет, в сочетании с цитологическим исследованием (ПАП-тест), каждые пять лет. Согласно рекомендациям Минздрава РФ, скрининг должен проводиться в возрасте 21-30 лет — раз в три года с применением цитологического исследования, с 30 до 65 — раз в пять лет котестирование (цитология и ВПЧ-типирование). Рекомендован охват не менее 80% женского населения, однако это условие выполняется хорошо если наполовину.
Мировая практика показывает, что скрининг с приоритетным применением ВПЧ-тестирования снижает заболеваемость РШМ. Потоковый скрининг на основе традиционной цитологии малоэффективен: у женщины с позитивным результатом теста на ВПЧ цитологическая картина может быть нормальной. Целесообразно организовать ВПЧ-скрининг и в РФ. Вероятно, такая программа должна быть в каждом регионе, сделать федеральную программу не представляется реальным.
Хотя в России разработаны свои тесты на ВПЧ, валидированы в нашей стране только зарубежные, отметила Ольга Шипулина. При этом наши тесты занимают заметный сектор мирового рынка и демонстрируют отличное соотношение «цена-качество».

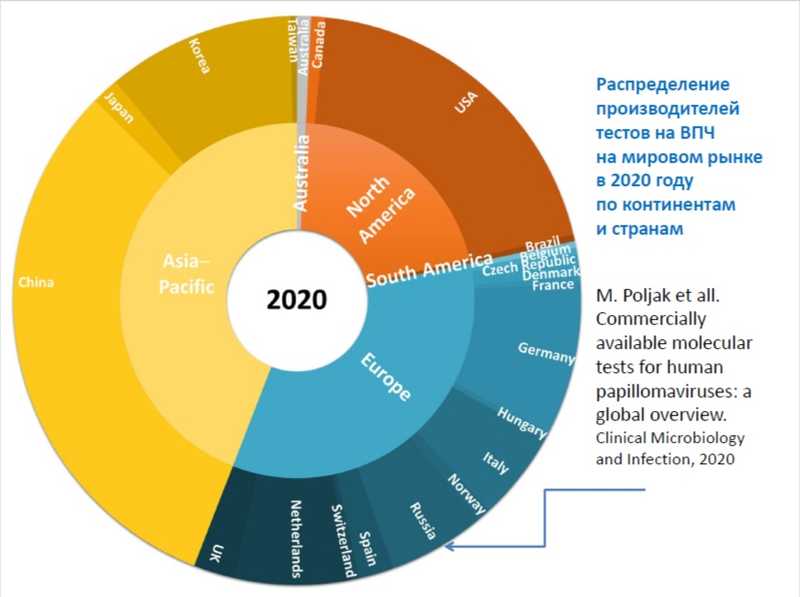
Однако чувствительность скринингового теста сильно зависит от выбора мишени. Вирус встраивается в геномную ДНК и при этом теряет некоторые области своего генома. Если выбрать такую область, есть риск потерять чувствительность. С результатами сравнения российских тестов можно ознакомиться в журнале «Вопросы кольпоскопии» (№ 3, 2022, с.26).
Коронавирусная пандемия «обеспечила» приборную базу, которую можно теперь использовать в том числе для выявления ВПЧ. В отдельных регионах России уже работают скрининговые программы — в Кемеровской области (ВПЧ плюс цитология), в Республиках Саха и Бурятия. Интересно, что в двух последних внедряется самостоятельное взятие мазка. Об этом подходе докладчица обещала рассказать в конце сессии.
Любовь Короленкова (НМИЦ онкологии им. Н.Н. Блохина Минздрава России) подробно рассмотрела роль тестирования на ВПЧ в диагностике и постлечебном мониторинге тяжелых дисплазий.
Дисплазия шейки матки, или цервикальная интраэпителиальная неоплазия (CIN) — это появление в толще покровного эпителия шейки матки клеток с различной степенью атипии. Своевременная диагностика CIN с последующим лечением предотвращает развитие инвазивного рака и приводит к выздоровлению. Инвазивные раки не являются целью диагностики, подчеркнула Любовь Ивановна; ее цель – неоплазии. Она напомнила, что высокоонкогенные ВПЧ инфицируют стволовые клетки в так называемой переходной зоне (на границе однослойного цилиндрического и многослойного плоского эпителия шейки матки). В зоне поражения могут сосуществовать различные клоны клеток с разными генетическими аномалиями, поэтому у одной пациентки могут наблюдаться разные степени CIN. С возрастом и увеличением времени персистенции ВПЧ возрастают риски гиподиагностики, так как зона трансформации смещается в цервикальный канал и поражаются эндоцервикальные крипты.
Георгиоса Папаниколау Любовь Ивановна назвала «самым известным греком после Александра Македонского». Первое его сообщение в 1928 году о диагностике РШМ цитологическим методом было встречено скептически; считалось, что диагноз возможен только при хирургическом вмешательстве. Однако в 1943 году у Папаниколау вышла статья в специализированном издании, а в 1954 году был опубликован Atlas of Exfoliative Cytology, и фактически появилась новая медицинская специальность.
ПАП-мазок, как его теперь называют, спас жизнь миллионам женщин. Удаление трансформированной зоны позволяет и уточнить диагноз, и полностью излечить большинство больных. Из 1000 женщин, получивших лечение, только 4 достигают рака. Тем не менее цитологические методы существенно уступают ВПЧ-тесту, у которого близкая к 100% чувствительность и предсказательная ценность отрицательного результата. Даже хорошие мазки могут скрывать инвазию, напомнила докладчица.
Тест на ВПЧ рекомендует ВОЗ в качестве первичного скринингового теста; сейчас все чаще говорят о том, что в скрининге он должен заменить цитологию. Российские клинические рекомендации по патологиям шайки матки предусматривают и жидкостную цитологию, и генотипирование ВПЧ, и молекулярные маркеры коэкспрессии онкобелков p16/Ki67. Хотя это и не оплачивается по ОМС, пути для следования мировым тенденциям в скрининге для врачей и пациентов открыты.
Докладчица рассказала о нескольких клинических случаях, в которых выявление ВПЧ высокого риска и контроль вирусной нагрузки сыграли важную роль. Тактика немедленного лечения CINI имеет все преимущества перед динамическим наблюдением. Эксцизионная тактика обязательна, если подозревается патология. После полноценной эксцизии ВПЧ-тест становится отрицательным, а рост вирусной нагрузки говорит о рецидиве. Что касается иммуномодулирующего лечения, оно целесообразно и способствует элиминации вируса в ходе комплексного лечения, в дополнение к эксцизии или иной основной тактике. Но главная ошибка практических врачей – монотерапия иммуномодулятором при CIN II+.
В конце доклада Любовь Ивановна ответила на многочисленные вопросы слушателей.
Гульнара Лёшкина (ЦНИИ эпидемиологии Роспотребнадзора) представила результаты работы, в которой сравнивалась эффективность совместного ВПЧ-ПАП-теста и только ПАП-теста.
В нашей стране с 2012 по 2022 год наблюдается 40%-ный рост выявления рака in situ (в начальной стадии), и это правильно, так как позволяет предупредить развитие тяжелых форм.
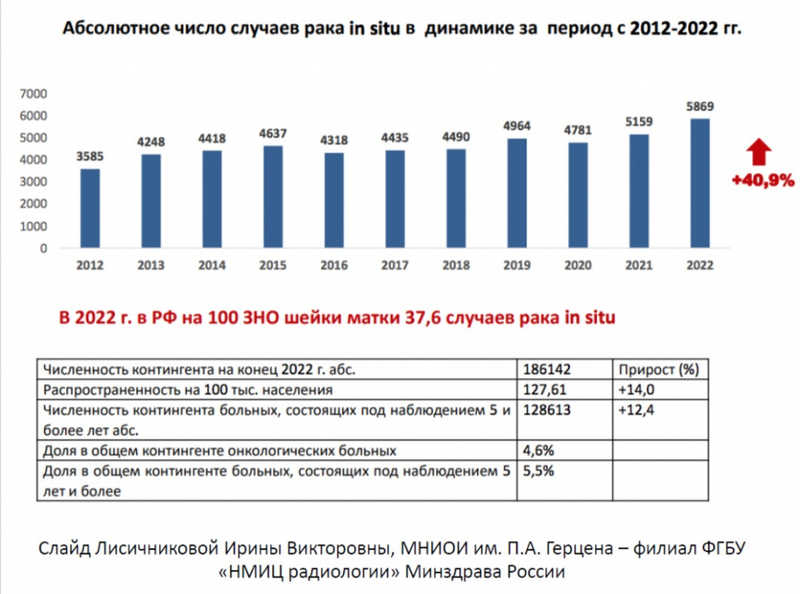
Но для скрининга в основном используется цитологический метод, ВПЧ-скрининг слабо доступен. Котестирование обоими методами проводится в ЦНИИЭ; докладчица отметила, что бланк для его результатов разработала Ольга Шипулина.
Использование жидкостной цитологии уменьшает количество неадекватных тестов до 0,2%. (У традиционной цитологии это могут быть проценты или десятки процентов).
Интересно, что знание результата ВПЧ теста существенно влияет на качество цитологического исследования. Если ВПЧ выявлен, цитолог не пропускает даже единичные группы аномальных клеток, которые могли бы остаться незамеченными, учитывая ограниченное время на каждое исследование. Улучшение касается даже результатов жидкостной цитологии. Также, когда цитолог знает результат ВПЧ-теста, завышается частота ASC-US (обнаружение атипичных клеток неопределенного значения). Это не всегда хорошо: был случай, когда из-за одной клетки с увеличенным ядром пациентку, планирующую ЭКО, репродуктологи чуть не отправили на биопсию.
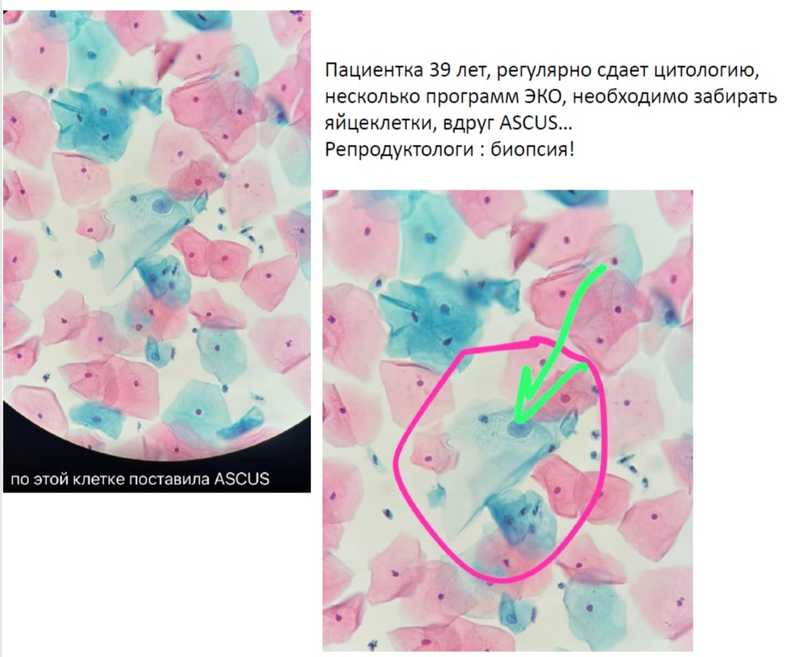
Чем больше проводится совместных тестов цитология плюс ВПЧ, тем лучше; от этого зависят судьбы пациенток, подчеркнула в заключение Гульнара Витальевна.
Обзор эпидемиологической ситуацию по ВПЧ и ВПЧ-ассоциированным поражениям сделал Платон Лопухов, доцент кафедры эпидемиологии и доказательной медицины Института общественного здоровья им. Ф.Ф. Эрисмана Сеченовского университета.
В течение жизни ВПЧ инфицируются 70—80% людей, ведущих половую жизнь, хотя у большинства инфекция не приводит к развитию онкопатологии. Число ВПЧ-ассоциированных случаев рака может превышать 700 тысяч ежегодно. Успехи диагностики, профилактики и лечения РШМ позволяют говорить об элиминации этого вида рака. Но при этом в мире нет единого подхода к эпиднадзору. Снижается охват вакцинацией против ВПЧ: в 2021 году по сравнению с 2019-м вакцину против ВПЧ не получили на 3,5 млн девочек больше, чем в 2019-м. Поэтому глобальные цели по элиминации РШМ, очевидно, будут достигнуты еще не скоро.
Наиболее изучены альфапапилломавирусы, к которым и относятся высокоонкогенные типы.
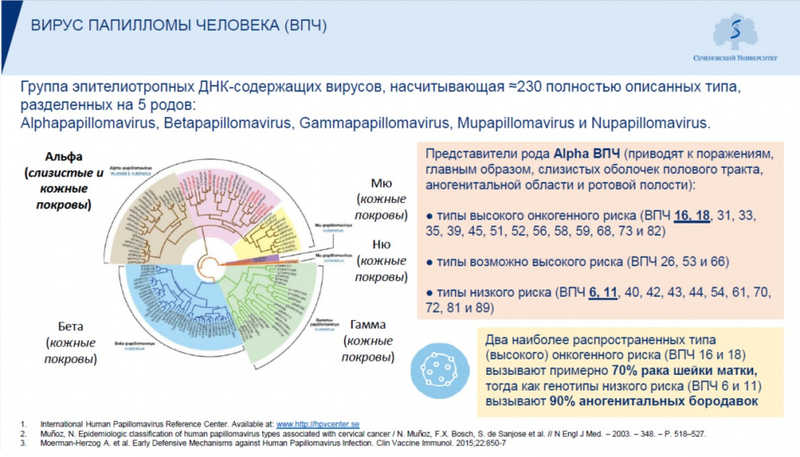
Доминирующий путь передачи — половые контакты любого типа, но существуют и неполовые пути передачи, например, инфекция при трансвагинальном УЗИ. Возможна передача от матери новорожденному. Даже при использовании барьерных средств контрацепции инфекция может передаваться через незащищенные поверхности половых органов. Ожидаемо риск возрастает с количеством половых партнеров у индивида и у его постоянного партнера.
В РФ частота инфицированности онкогенными штаммами в различных группах женского населения — 13–40%. ВПЧ-16 лидирует и в здоровой популяции, но у женщин с РШМ он встречается во много раз чаще других подтипов.

К ВПЧ-ассоциированным относятся различные типы рака, в том числе те, что встречаются у мужчин.

Но РШМ — это не десятки, а сотни случаев в год. По оценкам, в 2020 году было диагностировано более 604 тысяч новых случаев рака шейки матки, причем каждый пятый — у женщины до 40 лет. Наибольшее бремя РШМ — в странах с низким уровнем дохода, где недоступны скрининг и лечение. Ожидается, что в 2030 году вместо снижения, планируемого ВОЗ, может быть рост: 700 тысяч новых случаев, 400 тысяч смертельных исходов.
ВПЧ страшен тем, что это «молодой» рак — четвертый по распространенности у женщин в целом, но второй у женщин до 44 лет.

В РФ стандартизированная заболеваемость в 2020 году составила 13,7 на 100 тысяч женщин. Наблюдаемое в пандемийные годы «снижение», скорее всего, связано с недодиагностикой, и можно ожидать отсроченного обратного эффекта.
Ожидается, что по демографическим причинам численность женщин 30–39 лет в России к 2030 году сократится на 33,8%, по словам первого замминистра труда и социальной защиты РФ Ольги Баталиной. На эту возрастную группу приходится примерно половина всех рождений. Заболеваемость РШМ и смертность от этого вида рака еще ухудшит ситуацию.
В целом заболеваемость ИППП в России и в Москве снижалась с середины 2000-х до 2020 года, но в последние годы начался рост. Увеличилось число случаев сифилиса, особенно среди мигрантов. Доля пациентов с аногенитальными бородавками снижается, однако вызывает тревогу то факт, что среди них есть и вызванные высокоонкогенными подтипами ВПЧ.
Платон Дмитриевич снова напомнил о стратегии «90-70-90» и препятствиях к ее реализации. Гендерно-нейтральный подход к вакцинации (и мальчиков, и девочек) позволил бы элиминировать вирус при охвате 70%, а не 90%. Также повысить эффективность программы могла бы догоняющая вакцинация мужчин в возрасте до 26 лет. Но такой госпрограммы мы в ближайшее время не увидим, отметил докладчик.
Большая проблема – отсутствие российской вакцины против ВПЧ. Возможно, она появится, и тогда ее следует включить в нацкалендарь прививок. Пока в России вакцинация против ВПЧ проводится в отдельных регионах, в рамках дополнительных программ или региональных календарей прививок. Это в том числе Москва и Московская область, Санкт-Петербург, Тульская и Калужская области. В 2021 году Правительство РФ планировало внесение прививки в нацкалендарь на 2024 год, но сейчас оно перенесено на 2026-й.
Мария Пахарукова (ГАУ здравоохранения Свердловской области «Клинико-диагностический центр», Екатеринбург) рассказала о своем исследовании распространенности ВПЧ у пациенток с плоскоклеточной карциномой шейки матки и вульвы.
Рак вульвы изучен меньше, чем ВПЧ, из-за его редкой встречаемости. В отличие от РШМ, многие случаи этого вида рака ВПЧ-негативные, поэтому ВПЧ-диагностику важно сочетать с иммуногистохимическими методами — выявлением статуса по р16 и р53. Вариант р16+/р53wt может быть связан с ВПЧ-инфекцией, р16–/р53mut, реже р16+/р53wt соответствует ВПЧ-независимой карциноме, и прогноз в этом случае хуже.
Докладчица с коллегами на базе ГАУЗ СО «КДЦ» провели ретроспективное исследование пациенток со впервые выявленным плоскоклеточным раком вульвы или предраком, а также пациенток без патологии вульвы. Исследовали экспрессию белков р16 и р53, а также выделяли ДНК ВПЧ и генотипировали вирус. Использовали как парафиновые блоки, так и материалы жидкостной и традиционной цитологии.
Классификация на основе морфологии, возраста и других признаков дает значительный процент ошибок. Исследование только ДНК ВПЧ позволяло определить статус новообразования со специфичностью 75,47%, иммуногистохимия — со специфичностью 93,23%.
Спектр подтипов вируса оказался более узким, чем при РШМ, причем преобладали наиболее онкогенные, такие как ВПЧ-16. Значения вирусной нагрузки и частота полиинфекций не различались.
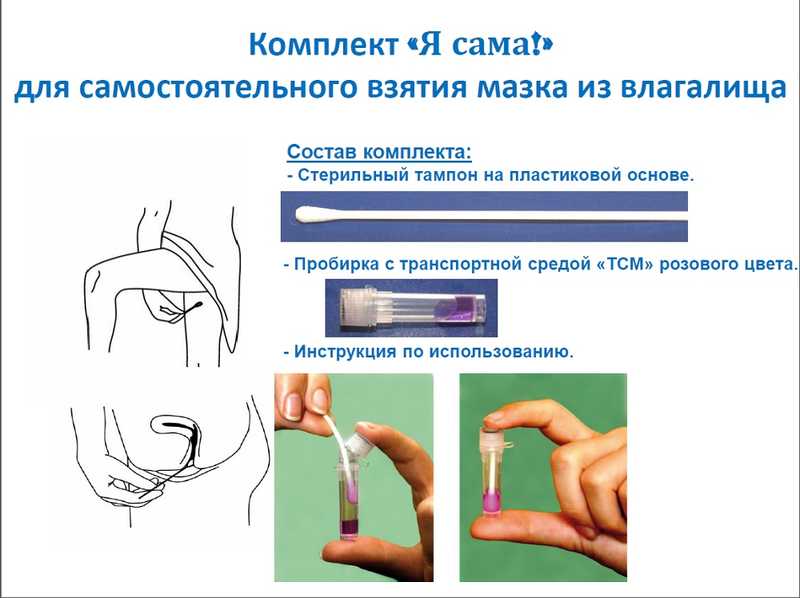
В завершение секции Ольга Шипулина (АО «Лабквест») привела доказательства в пользу того, что самостоятельное взятие мазка на ВПЧ — хорошая альтернатива взятию мазка в медучреждении. Достоверность результатов остается высокой, если используются хорошие материалы и качественные тест-системы. Это подтверждает как зарубежный опыт, так и российские пилотные проекты.
История самовзятия мазка на ВПЧ началась в 2006 году: в Нидерландах более 27 тысяч женщин, отказавшихся прийти на скрининг, получили наборы для самостоятельного взятия мазка, и более четверти прислали образцы. (В небольшой контрольной группе, которой просто звонили и звали на повторный скрининг, откликнулись только 16%). Невалидных образцов было лишь 0,3%. С 2017 года в Нидерландах женщины имеют возможность брать мазки самостоятельно. А самая ранняя публикация по этой теме появилась в «Ланцете» еще в 1999 году.
Сейчас предлагаются разные варианты приспособлений для сбора образца: получение лаважа (смыва), щеточки (brush), тампоны для мазков (swab). Особое значение эта опция приобрела во время локдауна; больше всего публикаций приходится на этот период.
Чувствительность ВПЧ-теста на основе самостоятельно взятого образца сильно зависит от устройства для взятия и тест-системы, но в целом согласованность с врачебным взятием довольно высока (91–96%).
В России примерно 75% женщин не проходят обследования, даже если у них есть гинекологические проблемы — из-за нехватки времени, недостатка средств, чувства неловкости или страха перед процедурой, боязни разглашения информации о результатах анализа, удаленности медицинского учреждения.
В ЦНИИЭ исследование самостоятельного взятия мазка тоже начали проводить с 2006 года, а первые публикации появились в 2010 году. Результаты подтвердили, что самостоятельное взятие даже лучше, частота выявления ВПЧ оказывается более высокой.
В 2012 году была проведена акция «Я сама!» для клиенток Центра молекулярной диагностики ЦМД, во время которой также проводилось исследование на бактериальную флору. Удалось получить 802 адекватных образца, недостаточно адекватных (с малым количеством клеток) — 11, неадекватный — один.
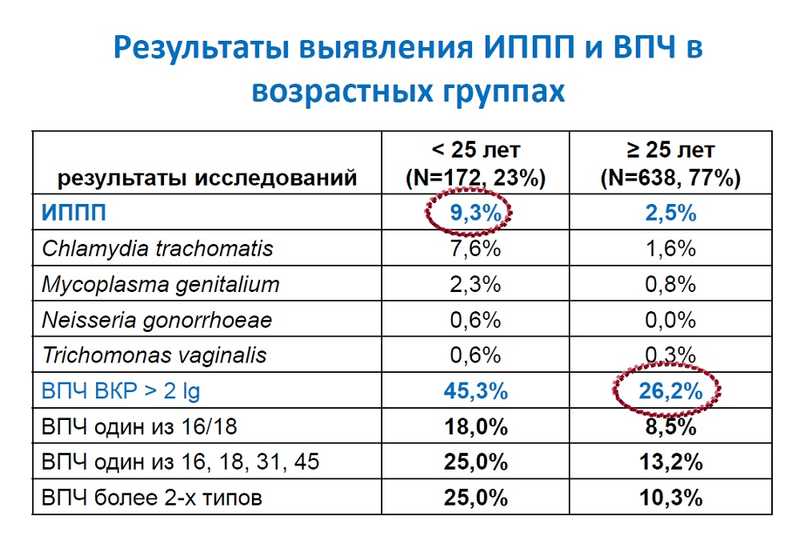
Для женщин младше 25 лет скрининг ожидаемо неэффективен, так как не менее чем у половины женщин этой возрастной группы ВПЧ будет найден, но у большинства вирус просто элиминируется без патологий. У женщин старше 25 лет ВПЧ встречается реже, а наиболее опасные подтипы 16 и 18 — только у 8,5%. Примечательно, что среди женщин, получивших положительный результат, 18% ранее сдавали ПАП-мазок и получили отрицательный результат, но когда препараты пересмотрели, в 38% из них нашли атипичные клетки.
В настоящее время наборы для самовзятия мазка предлагают «Инвитро» и «ЛабКвест» (линейка Q test). Используются импортные устройства Qvintip и FLOQSwabs (ФЛОКС), однако наладить производство таких устройств в РФ вполне возможно.
Информация о докладчиках
Короленкова Любовь Ивановна, д.м.н., ст.н.с., врач-онколог, Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина Минздрава России
Лёшкина Гульнара Витальевна, врач-цитолог КДЛ ФБУН ЦНИИ эпидемиологии Роспотребнадзора
Лопухов Платон Дмитриевич, к.м.н., доцент кафедры эпидемиологии и доказательной медицины Института общественного здоровья им. Ф.Ф. Эрисмана Первого МГМУ им. И.М. Сеченова Минздрава России
Пахарукова Мария Юрьевна, и.о. зав. лаборатории цитологии Государственного автономного учреждения здравоохранения Свердловской области «Клинико-диагностический центр», Екатеринбург
Шипулина Ольга Юрьевна, к.м.н., директор департамента молекулярно-генетических исследований АО «Лабквест»


 Меню
Меню





 Все темы
Все темы




 0
0