МД-2023: Туберкулез в Иркутске XVIII века и современные вызовы
14 ноября прошла секция «Генодиагностика и геномная эпидемиология туберкулеза и других микобактериальных инфекций». Как обстоят дела с туберкулезом в Индии? Свойственен ли больным туберкулезом дисбактериоз, и влияет ли он на прогноз? Откуда пришел туберкулез в Иркутск XVIII–XIX веков? Какие методы сегодня применяются для диагностики туберкулеза и выявления лекарственной устойчивости? Ответы на эти и другие вопросы — в нашем материале.
В начале секции Урваши Синг (Urvashi B. Singh), MD, PhD, FAMS Department of Microbiology, All India Institute of Medical Sciences (New Delhi, India), прочитала доклад на тему «Whole genome sequencing to study tuberculosis transmission in India». Она рассказала о заболеваемости туберкулезом в трех штатах (Сикким, Ассам и Трипура). Ее научная группа анализировала сиквенсы возбудителя туберкулеза из образцов, собранных на территории этих штатов.
Они построили филогенетическое древо. Однако филогения не показывает пути передачи. Для этого строили трансмиссионное древо (transmission tree), чтобы понять, кто заразил кого и выявить потенциальные источники заражения. Была выявлена сложная сеть передачи заболевания.
Так, было продемонстрировано распространение инфекции от штата к штату и внутри штатов. В Сиккиме было показано большое количество высоко-трансмиссивных штаммов. Отмечено непрямое заражение.
Докладчица также привела примеры случаев заражения и рассказала о способах его предотвращения— ранний диагноз, раннее, интенсивное и полное лечение, скрининг популяции с повышенным риском, идентификация «горячих точек».
Миляуша Юнусбаева, к.б.н., ФГАОУ ВО «Национальный исследовательский университет ИТМО» (Санкт-Петербург), выступила с докладом «Дисбиоз кишечной микробиоты как предиктор неблагоприятного исхода туберкулеза легких».
Наглядный пример важной роли микробиоты для здоровья — опыты на гнотобионтных мышах. У них отсутствие контактов с микроокружением приводит к нарушению строения органов и тканей желудочно-кишечного тракта. Также страдает иммунная система — практически полностью отсутствует пул CD4 и CD8 лимфоцитов.
От года к году увеличивается интерес к связи микробиоты и туберкулеза. Исследовательская группа докладчицы включала в работу людей с впервые диагностированным туберкулезом без тяжелых сопутствующих патологий (например, диабета).
После поступления в стационар до приема первой дозы лекарства брали четыре пробы — фекалий, мокроты, сыворотки и крови. Через два месяца лечения снова отбирали пробы.
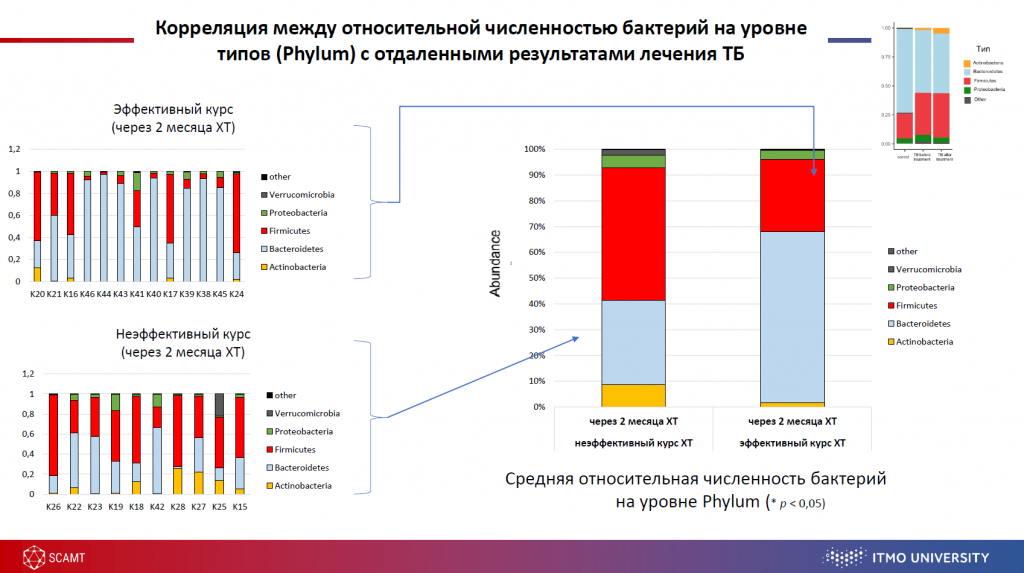
Кишечник больных туберкулезом характеризуется сильнейшим дисбиозом. У них снижается доля Bacteroidetes и повышаются доли Firmicutes, Proteobacteris и Actinobacteria. Изменения затрагивают более 230 бактериальных таксонов (32% от общего количества обнаруженных кишечных бактерий). Увеличивается доля представителей рода Escherichia, Blautia, Akkermansia, Megamonas.
Полногеномное секвенирование позволяет определить, какие метаболические процессы происходят в кишечнике. У больных туберкулезом в кишечнике были широко представлены метаболические процессы, необходимые для роста и деления бактерий (синтез аминокислот, витаминов, клеточной стенки и так далее).
Но за счет каких ресурсов бактерии начинают расти? Бактерии толстого кишечника в норме «специализируются» на расщеплении сложных углеводов. Но при дисбиозе на первое место выходит гликолиз (из глюкозы). То есть в первую очередь растут бактерии, отдающие предпочтение простым сахарам. Многие бактерии ферментируют их до лактата. Происходит повышенное брожение в кишечнике и лактоацидоз. Разрастание лактат-толерантной флоры приводит к воспалению. Также растет число бактерий, синтезирующих аэробактин (признак вирулентности штаммов).
Предварительные данные позволяют сказать, что у пациентов, успешно завершивших лечение, уже на втором месяце микробиом близок к здоровому. Возможно, исход зависит от микробиоты.
Пауло Миотто (Paolo Miotto), PhD, San Raffaele Scientific Institute (Milan, Italy), прочитал доклад «Next generation sequencing and diagnosis of drug resistance in tuberculosis: 2023 update». Он упомянул проблему тестирования на лекарственную чувствительность туберкулезной микобактерии. В частности, у ВОЗ нет рекомендованного метода быстрого тестирования на чувствительность к новым препаратам, а NGS-технологии не всегда доступны.
Применение полногеномного секвенирования может быть не оправдано. Есть свидетельства в пользу применения таргетированного NGS. Но хотя оно позволяет получить важные ранние результаты, у него не очень высокая чувствительность для новых препаратов, что говорит о необходимости тестирования фенотипа.
Докладчик также рассказал о новом дополненном каталоге мутаций и их связей с лекарственной резистентностью от ВОЗ, который позволяет лучше интерпретировать мутации, особенно в редко встречающихся вариантах. При его создании анализировалось больше изолятов, изменились некоторые биоинформатические инструменты.
Игорь Мокроусов, д.б.н., НИИ эпидемиологии и микробиологии им. Пастера (Санкт-Петербург), Института этнологии и антропологии имени Н.Н. Миклухо-Маклая РАН (Москва), Иркутского государственного университета (Иркутск), прочитал доклад на тему «Молекулярный анализ костных образцов из захоронений с православных кладбищ Иркутска XVIII–XIX веков: выявление и генотипирование M. tuberculosis». Он начал с истории города Иркутска и его географических особенностей.
Костный туберкулез давно находят в образцах. Но существуют другие аналогичные патологии. Желательно иметь молекулярное подтверждение туберкулеза.
Туберкулез в России — эпидемическое заболевание в конце XIX века, но в русских городах Сибири XVIII века — начала XIX века эпидемическое распространение туберкулеза было маловероятно из-за низкой плотности населения. Тем не менее, люди могли собираться в церквях, на ярмарках, и штаммы могли циркулировать.
Анализируется костный материал, и это нужно учитывать при интерпретации данных. Так, некоторые штаммы чаще выявляются у больных костным туберкулезом по сравнению с туберкулезом органов дыхания.
Еще одно соображение — генотип Beijing более распространен в Сибири.
В представленной работе проводился анализ костных образцов из захоронений с православных кладбищ XVIII-XIX веков в Иркутске на наличие морфологических изменений, связанных с туберкулезом, и ДНК его возбудителя. Ожидали обнаружить штаммы генотипа Beijing.
Выборка для палеопатологоанатомического исследования — 591 человек (382 с кладбища Спасской церкви и 209 с кладбища Крестовоздвиженской церкви).
Палеопатологические проявления исследовали макроскопически, делали описания морфологических изменений костей. Сравнивали с опубликованными случаями, советовались с палеопатологами. Обнаружили кости с изменениями, характерными для остеомиелита, сифилиса и туберкулеза.
Было выявлено 15 вероятных случаев туберкулеза. Для анализа взяли 19 образцов из 15 захоронений (дважды от четырех лиц).
Проводили экстракцию ДНК IS6110-ПЦР с гель-электрофорезом. Далее ставили ПЦР в реальном времени на три локуса — специфичный для M. tuberculosis, для Beijing и non-Beijing. Эксперименты, связанные с ПЦР, проводили на территории лаборатории, которая раньше никогда не работала с микобактриями. Реактивы были чистые и новые.
Сполиготипирование подтвердило — это не M. bovis. Это M. tuberculosis sensu stricto, но разные штаммы. По-видимому, не относятся к LAM.
Работали с сильно деградированной ДНК. Но все равно можно консервативно сказать, что в четырех образцах детектирован туберкулез. Это были мужчины преимущественно зрелого возраста.
Таким образом, были представлены биоархеологические и молекулярные доказательства туберкулеза в скелетных останках с православных кладбищ XVIII-XIX веков в Иркутске. С их помощью нельзя выявить распространение туберкулеза во времени и его половозрастное распространение. ДНК M. tuberculosis обнаружили у по крайней мере четырех человек. Комбинированный молекулярный анализ осторожно указывает на наличие разных штаммов. По крайней мере некоторые изоляты были вероятно европейского/российского происхождения.
Юлия Микулович, к.х.н, ФГБУ «Центр стратегического планирования и управления медикобиологическими рисками здоровью» ФМБА России (Москва), прочитала доклад «Новые отечественные ПЦР-тесты производства ФГБУ «ЦСП» ФМБА России для обнаружения и количественного определения ДНК M. tuberculosis complex и выявления генетических маркеров резистентности к рифампицину и изониазиду».
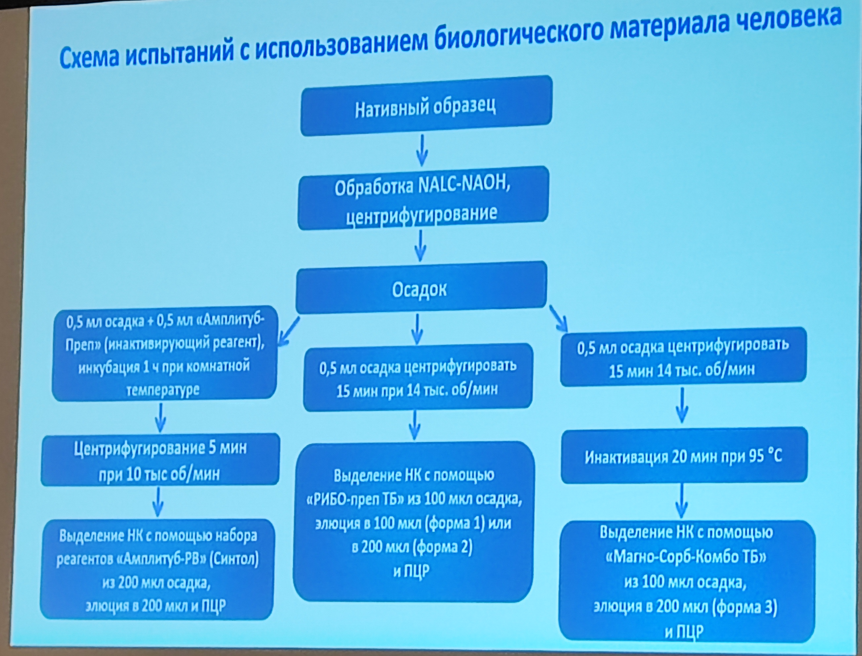
Основные этапы лабораторной диагностики туберкулеза: выявление МБТ в биоматериале, собранном до начала химеотерапии, дифференциация МБТ от НТМБ, определение лекарственной чувствительности (выявление генетических маркеров ЛУ МБТ с помощью молекулярно-генетических методов исследования или фенотипический тест определения ЛЧ (культуральный метод)).
ФГБУ «ЦСП» ФМБА России предлагает набор реагентов для обнаружения и количественного определения ДНК микобактерий туберкулезного комплекса методом ПЦР с гибридизационно-флуоресцентной детекцией — «АмплиТест МБТ». У него есть РУ № РЗН 2023/20838. Материал — биологический материал человека или бактериальная культура. Аналитическая чувствительность: 1*102 ГЭ/мл для качественного определения, 5*102 ГЭ/мл для количественного определения ДНК МБТ; 1*103 — 5*108 ГЭ/мл —линейный диапазон измерения.
Набор выпускается в трех формах комплектации. Первые две формы включают комплекты реагентов для ручного выделения НК, второй и третий — лиофилизированные комплекты реагентов. Первый набор рассчитан на анализ 100 образцов, включая контроли, а второй и третий — 96 образцов, включая контроли.
В наборе одна мультиплексная пробирка с детекцией по трем каналам: FAM/Green — качественное определение ДНК МБТ, HEX/Yellow/VIC — количественное определение ДНК МБТ, ROX/Orange — внутренний контроль.
Набор адаптирован к различным амплификаторам (например, CFX96, ДТпрайм и т.д.). Результаты интерпретируются автоматически с помощью спец ПО. Докладчица продемонстрировала, что означают различные полученные результаты и привела примеры графиков флуоресценции.
В клиническом испытании набор «АмплиТест МБТ» сравнили с набором «Амплитуб-РВ» от ООО «Синтол». Полученные двумя способами результаты совпали.
Преимущества набора «АмплиТест МБТ»: автоматическая интерпретация результатов, использование двух многокопийных мишеней для качественного определения ДНК МБТ. Также удобство работы с набором, экономия расходных материалов и удобство хранения благодаря наличию готовой реакционной смеси в лиофилизированном виде.
«АмплиТест МБТ-Резист-I Lyo» — набор реагентов для выявления мутаций, связанных с лекарственной устойчивостью микобактерий туберкулезного комплекса к рифампицину и изониазиду, методом ПЦР. Этот набор — улучшенный вариант «АмплиТест МБТ-Резист-I», готовые реакционные смеси в лиофилизированной форме удобно использовать.
В рамках клинического испытания набор сравнивали с «Амплитуб-МЛУ-РВ» от ООО «Синтол». Дискондартных образцов не обнаружено.
«АмплиТест МБТ-Резист-I Lyo» имеет преимущества по сравнению с другими наборами, например, производительность, безопасность в отношении контаминации продуктами ПЦР и выявление широкого спектра целевых мутаций.
Мария Рубель, ФГАОУ ВО «Национальный исследовательский университет ИТМО» (Россия) и University of Central Florida (Orlando, Fl., USA), выступила с докладом «Возможность использования многокомпонентных ДНК-наносенсоров для определения однонуклеотидных замен в GC-богатых участках генома на примере Mycobacterium tuberculosis».
Доля GC-оснований в M. tuberculosis — 65,62%, поэтому это актуальный вопрос.
С 2020 по 2021 год доля лекарственно-устойчивого туберкулеза увеличилась на 3%. Большинство мутаций связаны с однонуклеотидными вариантами (SNV).
Золотым стандартом генотипирования является полногеномное секвенирование. Оно обладает высоким качеством и наиболее информативно, но требует дорогого оборудования, специализированного программного обеспечения и квалифицированного персонала.
У других методов — свои недостатки, такие как плохая воспроизводимость, сложный и времязатратный процесс, необходимость в квалифицированном персонале.
Главные проблемы детекции GC-богатых участков ДНК — это высокая температура плавления GC-богатых фрагментов, образование шпилек и (или) G-квадруплекса, образование третичных структур.
Ученые Института общей генетики имени Вавилова разработали схему генотипирования, включающую девать генов. Для генотипирования выбрана сублиния Beijing-modern.
Система основывается на ДНКзимах и ДНК-наномашинах. ДНКзимы разделены так, чтобы они могли собираться только в случае полного совпадения с аналитами. Тогда они высвобождают флуоресцентный субстрат, который детектируется в смеси. Также используется платформа, которая помогает вытеснять вторую цепь из двухцепочесного ампликона.
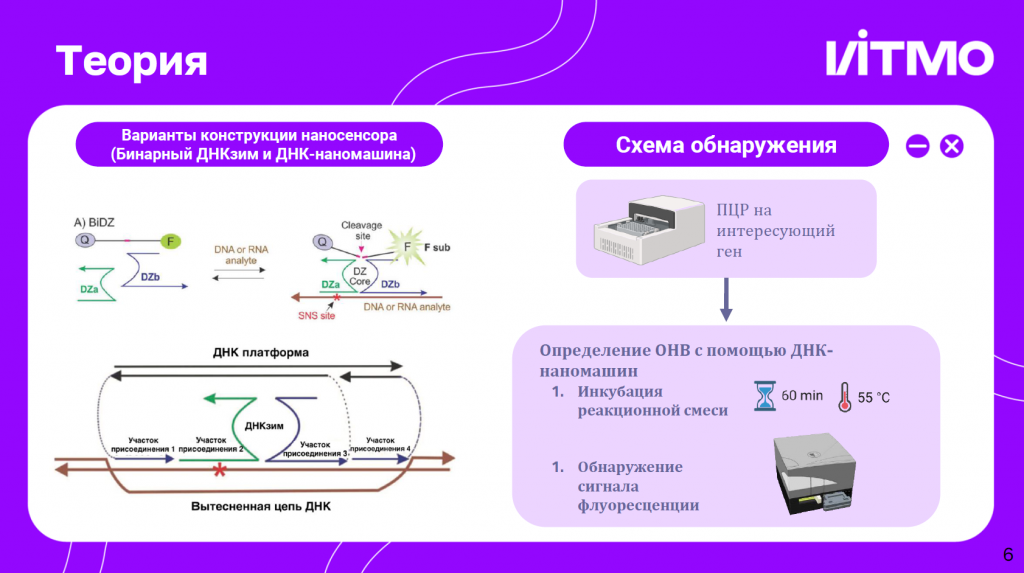
Цель проекта — создание сложных гибридизационных проб для определения SNV в GC-богатых участках M. tuberculosis. Система будет направлена на типирование SNV, характерных для сублинии Beijing-modern.
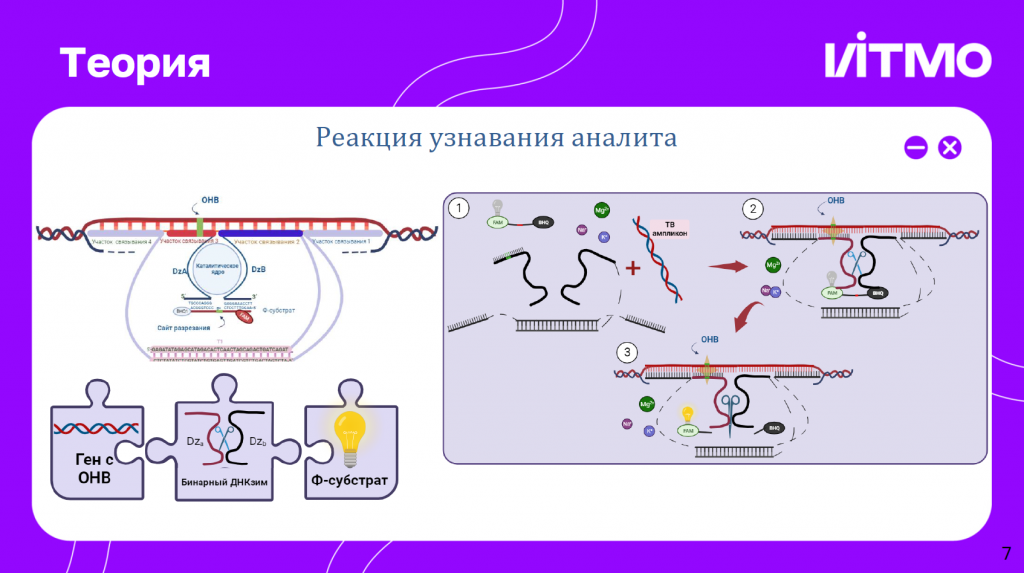
В эксперименте были получены ампликоны, подходящие к сенсору, а также укороченные с одной стороны ампликоны.
Также ДНК-машина была модифицирована с помощью toehold-опоры, прикрепленной к одному из праймеров. Праймеры в этой системе подобраны так, чтобы ампликон соответствовал длине сенсора. Все это может способствовать лучшему включению сенсора в друхцепочечный ампликон. Результатов пока нет, но уже получены ампликоны.
Софья Андреевская, к.м.н., ФГБНУ «Центральный научно-исследовательский институт туберкулеза» (Москва), прочитала доклад на тему «Генотипическая устойчивость Mycobacterium tuberculosis к фторхинолонам: частота формирования и биологические особенности мутантных клонов». Фторхинолины — основная группа препаратов, применяемых для лечения туберкулеза со множественной лекарственной устойчивостью. Мишень — ДНК-гираза, необходимая для осуществления процессов репликации и транскрипции в клетке МБТ.
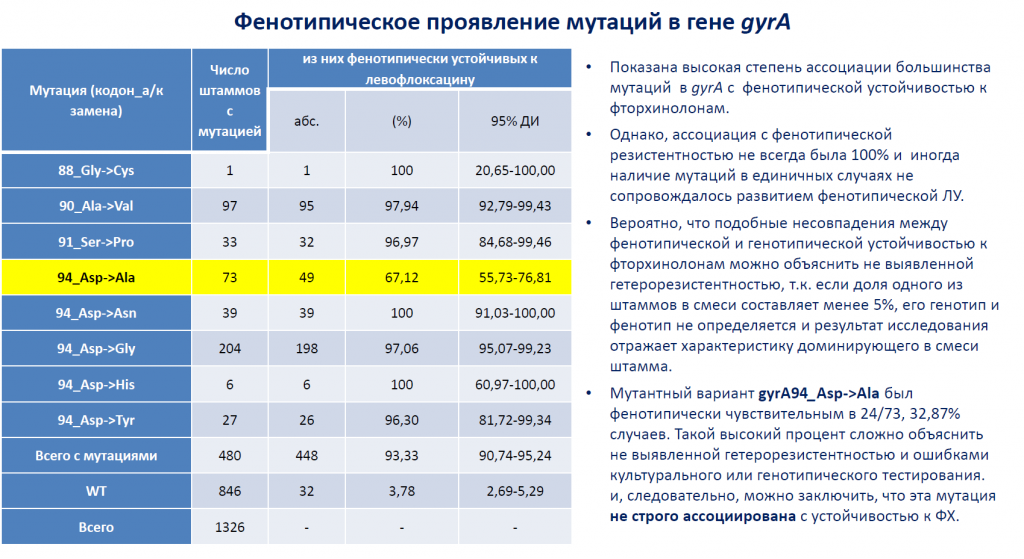
Устойчивость к фторхинолам в 60–90% случаев связана с мутациями в области QRDR гена gyrA, кодирующего альфа-субъединицу гиразы. В каталоге мутаций МБТ ВОЗ прописано 20 мутаций в гене gyrA, восемь ассоциированы с устойчивостью к LFX.
Цель исследования — описать частоту встречаемости и характер мутаций в gyrA и оценить биологические особенности мутантных клонов.
Было проведено продольное ретроспективное наблюдательное исследование, охватывающее значительное число случаев туберкулеза за 2011–2019 годы. Исследован материал от всех поступивших в ФГБНУ «ЦНИИТ» больных (n=3656) при первом обращении и в динамике, положительный на наличие ДНК МБТ и (или) культурально. Также изучили конкурентный фитнес штаммов МБТ с различной структурой gyrA.
Использовали культуральные и молекулярно-генетические методы.
Мутации в gyrA были выявлены в 27% случаев. Как правило, это были единичные мутации (93%). В 55 случаях результаты определения лекарственной устойчивости различались в динамике (гетерорезистентность). Она считается одним из основных этапов развития лекарственной устойчивости у бактериальных изолятов.
Гетерорезистентные популяции могли содержать как устойчивые, так и чувствительные к фторхинолам пулы МБТ с разными мутациями в gyrA. Как правило, смешанные популяции выделяли от леченых больных.
Возникновение мутаций в gyrA происходит на фоне уже сформированного МЛУ-генотипа.
Также исследовали конкурентный фитнес мутантных штаммов.
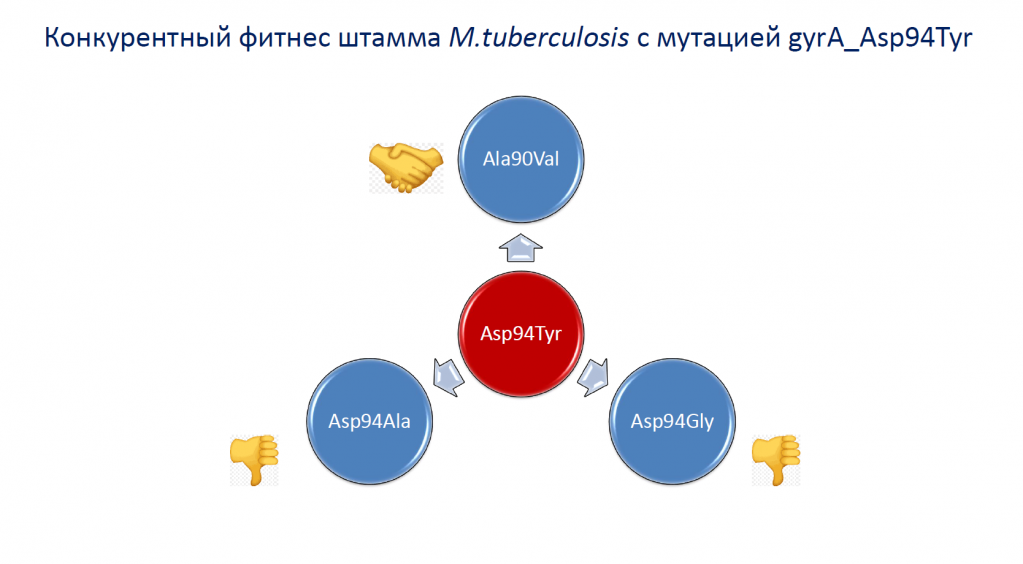
Наиболее перспективными в эволюционном плане является мутант gyrA_Ala90Val, имеющий восходящий тренд распространения в популяции, высокий показатель конкурентного фитнеса и всегда приводящий к формированию резистентности.
Егор Шитиков, к.б.н., ФГБУ «Федеральный научно-клинический центр физико-химической медицины им. академика Ю.М. Лопухина» ФМБА России (Москва), прочитал доклад «Унифицированная классификация микобактерий туберкулезного комплекса (MBTC): от филогеномики к клинике». Эти бактерии — генетически мономорфный микроорганизм, частота мутаций — 1*10(-7) замен на нуклеотид в год (0,3–0,5 SNP на геном в год).
MBTC называют иногда экотипами одного вида, а не разными видами. Есть проблема их генотипирования. В связи с этим было проведено исследование с целю совершенствования систем генотипирования MBTC для повышения достоверности ассоциации между генетическими и фенотипическими признаками патогена. Задачи: формирование коллекции геномных последовательностей MBTC, реконструкция филогении MBTC с учетом современных методов генотипирования, разработка и валидации универсальной номенклатуры, модернизация существующих скриптов для поиска делеций, исследование геномной организации и мутационного профиля изолятов микобактерии сублинии L2.2.M4.5 (Beijing B0/W148) в ассоциации с фенотипом.
Для этого из базы NCBI загружено более 18 тыс. геномов, проанализировано более 10 публикаций по теме исследования (номенклатуры MBTC), выбрана унифицированная коллекция референсных геномов (670 шт.).
Докладчик представил их классификацию, а также систему из 213 баркодов. Базовые уровни содержат по два полиморфизма. Каждый последующий уровень должен содержать полиморфизм предыдущего уровня. Пятиуровневая цифровая номенклатура представляется наиболее удобной для генотипирования.
Филогенетическое разнообразие MTBC на уровне корневых единиц строго детерминировано, новые классификации только уточняют принадлежность к определенной группе.
Есть множество программ для выявления SNP, но практически не программ для поиска делеций. С помощью программы для поиска делеций было выявлено 14 тыс. делеций на 700 образцах. Посмотрели на распределение делеций, нашли наиболее часто представленные, а также публикации, где они описаны.
Зачем все это делать? Сублиния Beijing B0 распространена в России. Она не так давно зародилась, при этом она довольно вирулентная и устойчивая к ряду препаратов. Имеет две большие инверсии. Можно оценить время образования кластера и понять, когда возникла устойчивость к тем или иным антибиотикам.
Вячеслав Журавлев, к.м.н., ФГБУ «СПб НИИФ» Минздрава России (Санкт-Петербург), выступил с докладом «Запрос клиницистов и фтизиатров в отношении молекулярной генетики возбудителя туберкулеза. Потребности и реальность». Он подчеркнул важность характеристики пациентов перед назначением химиотерапии. Еще раньше пациентов разделяли на медленных и быстрых ацетиляторов, что позволяло вычислить необходимую дозу. Сейчас молекулярная генетика должна быть не очень дорогой и очень специфичной. Нужен быстрый тест, который позволит типировать пациентов.
Физиатрия никак не хочет отказаться от архаичных методов выявления микобактерии, таких как микроскопия по Цилю — Нильсену. Она неспецифичная, низкочувствительная, не очень дешевая, неинформативная, но ее все равно применяют даже при доступности молекулярно-генетических методов. Докладчик обратил внимание на проблему контаминации, а также идентификации нетуберкулезных микобактерий и назначения адекватной терапии.
Информация о докладчиках
Urvashi B. Singh, MD, PhD, FAMS Department of Microbiology, All India Institute of Medical Sciences (New Delhi, India)
Миляуша Мусиевна Юнусбаева, к.б.н., ФГАОУ ВО «Национальный исследовательский университет ИТМО» (Санкт-Петербург)
Paolo Miotto, PhD, San Raffaele Scientific Institute (Milan, Italy)
Игорь Владиславович Мокроусов, д.б.н., НИИ эпидемиологии и микробиологии им. Пастера (Санкт-Петербург), Института этнологии и антропологии имени Н.Н. Миклухо-Маклая РАН (Москва), Иркутского государственного университета (Иркутск)
Юлия Львовна Микулович, к.х.н, ФГБУ «Центр стратегического планирования и управления медикобиологическими рисками здоровью» ФМБА России (Москва)
Мария Сергеевна Рубель, ФГАОУ ВО «Национальный исследовательский университет ИТМО» (Россия) и University of Central Florida (Orlando, Fl., USA)
Софья Николаевна Андреевская, к.м.н., ФГБНУ «Центральный научно-исследовательский институт туберкулеза» (Москва)
Егор Александрович Шитиков, к.б.н., ФГБУ «Федеральный научно-клинический центр физико-химической медицины им. академика Ю.М. Лопухина» ФМБА России (Москва)
Вячеслав Юрьевич Журавлев, к.м.н., ФГБУ «СПб НИИФ» Минздрава России (Санкт-Петербург)


 Меню
Меню





 Все темы
Все темы




 0
0