МД-2023: Передовые технологии молекулярной диагностики
Пленарное заседание третьего дня конференции «Молекулярная диагностика 2023» напомнило участникам, что современные диагностические методы — это далеко не только ПЦР. Среди технологий, о которых рассказали докладчики, — российский электронный нос для выявления заболеваний дыхательных путей, гидрогелевые биочипы из ИМБ и ДНК-наносенсоры из ИТМО, амплификация без праймеров, анализ единичных клеток и секвенирование микроРНК.

Елена Кошель.
Фото:
Дмитрий Хромов
«Электронный нос», определяющий, чем болен человек, — не фантастика, а дело близкого будущего, говорит Елена Валериевна Агина (Институт синтетических полимерных материалов им. Н.С. Ениколопова РАН, МГУ им. М.В. Ломоносова). Диагностика заболеваний по летучим органическим соединениям (ЛОС) в выдыхаемом воздухе имеет очевидные преимущества — неинвазивность, быстрота, низкий риск вторичных инфекций, а также возможность массовой диагностики в общественном месте.
Исследование выдыхаемого воздуха можно проводить и у пациентов на ИВЛ, и у совсем маленьких детей (с 2-3 лет). В выдохе человека много информативных ЛОС — аммиак, ацетон, оксид азота, сероводород. Основные используемые методы зависят от конкретных маркерных ЛОС: это могут быть различные варианты масс-спектрометрии, с предварительной концентрацией пробы или без, лазерные оптико-акустические методы, собственно электронный нос, определяющий состав воздуха с помощью массива сенсоров. Последний метод хорошо подходит для создания портативных приборов.
Существующие коммерческие электронные носы используют металл-оксидные сенсоры, масс-спектрометрию, флэш-хроматографию. Металл-оксидные сенсоры недостаточно чувствительны (реагируют на концентрации больше 1 ppm), отметила докладчица. Разработчики из Ionicon (Австрия) применили протонную масс-спектрометрию для анализа воздуха при сердечно сосудистых заболеваниях. Например, характерный маркер в спектре ЛОС у пациентов с хронической сердечной недостаточностью — ацетон, при нарушении выброса левого желудочка сердца — ацетон в комбинации с некоторыми другими соединениями. Но ацетон также коррелирует с сахарным диабетом, в том числе скомпенсированным, поэтому плохо подходит для диагностики.
Российские разработчики выбрали вариант без определения конкретного маркера — режим «черного ящика». Для достоверной диагностики определяются несколько ЛОС и соотношение их концентраций, формируется учебная выборка, где масс-спектры используются как фингерпринты заболеваний.
Обработка данных, машинное обучение имеют ключевую значимость. Прибор SpiroNose нидерландского разработчика Breathomix (металл-оксидные сенсоры) хорошо различает здоровых и пациентов с легочными заболеваниями, но разные типы заболеваний — уже не так хорошо. По мнению докладчицы, это «не аппаратная проблема, а проблема анализ данных».
Идея использования электронного носа в клинике развивается во всем мире; например, SpiroNose пробовали применить для детекции отклика на иммунотерапию при немелкоклеточном раке легкого; в таких исследованиях очень важна оперативность.
Российская разработка — лазерный оптико-акустический газоанализатор — имеет хорошие характеристики. Еще в 2016 году была опубликована статья о различении внебольничной пневмонии и туберкулеза легких этим методом.
Елена Валериевна показала фото первой версии прибора, созданного в Институте синтетических полимерных материалов; в этот прибор «никто не верил, кроме Германа Александровича Шипулина» (см. секцию по биобезопасности на МД-2021). А затем — актуальную версию.

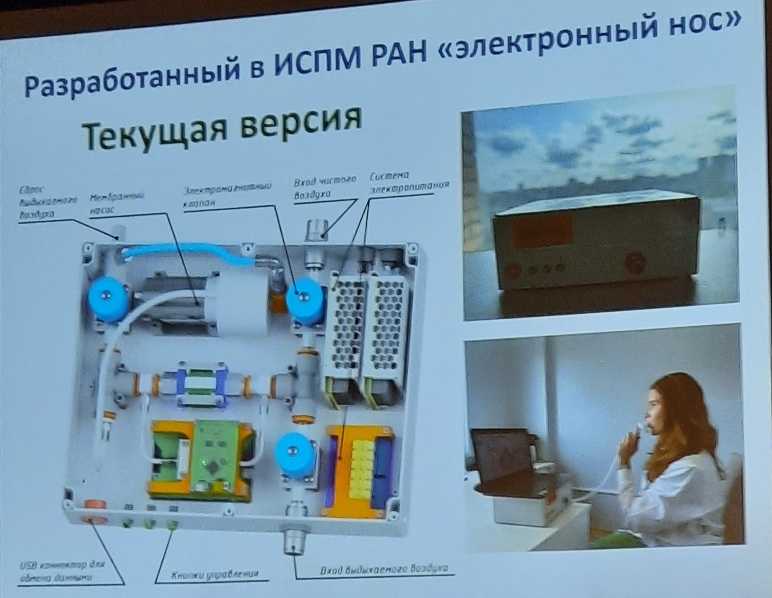
Теперь прибор уже различает инфицированных коронавирусом и здоровых людей, причем ложноотрицательных результатов не более 1%. Ложноположительных больше — это в том числе курильщики, люди с ХОБЛ, диабетом и астмой, а также те, кто недавно принимал алкоголь. На втором этапе «электронный нос» уже не путал диабет и астму с COVID-19; таким образом, побочным результатом стала возможность диагностировать астму. С туберкулезом пока еще сложно, но и эту проблему можно будет решить. Нужны клинически достоверные обучающие выборки, разработка адекватных алгоритмов и обязательно — тесное сотрудничество с клиницистами, подчеркнула докладчица.
Дмитрий Грядунов (Институт молекулярной биологии им. В.А. Энгельгардта РАН) рассказал о новых успехах хорошо известного специалистам подхода — гидрогелевых биочипов — в исследовании социально значимых заболеваний. На чипах находятся гидрогелевые полусферы диаметром 50–200 мкм, в которых иммобилизованы зонды (например, олигонуклеотиды, но это могут быть также ферменты и другие белки и молекулярные комплексы — даже CRISPR-Cas). Детекция осуществляется с помощью флуоресцентного анализатора. Технология позволяет детектировать даже однонуклеотидные замены в ДНК, а также исследовать много аналитов в образце одновременно. Производство гидрогелевых чипов хорошо отработано и полностью импортозамещено, отметил Дмитрий Александрович.
Среди применений биочипов — выявление лекарственной устойчивости у бактерий, генотипирование ВИЧ, вирусов гепатита С и гриппа, а также мультиплексный иммуноанализ, онкогенетика и фармакогенетика, выявление предрасположенности к заболеваниям, диагностика тяжелых респираторных заболеваний, включая COVID-19, и даже идентификация личности
Неожиданные результаты принесли исследования антибиотикорезистентности у возбудителя гонореи в РФ. Во всех странах при гонококковой инфекции рекомендованы цефалоспорины третьего поколения и макролиды, но в России появились мутации устойчивости и к азитромицину, и к цефалоспоринам, по-видимому, в результате транс граничного переноса. Начата регистрация чипа для определения чувствительности гонококка к лекарственным препаратам. После технических испытаний в Росздравнадзоре начнутся клинические испытания.
Разработан биочип для исследования генетической предрасположенности к болезни Альцгеймера. Самый известный ген предрасположенности — конечно, ApoE, но GWAS выявили целый ряд других генов, вовлеченных в процесс амилоидообразования и другие опасные процессы. Появляются модели полигенного риска; на основе этих данных и был создан чип, который включает более 20 маркеров. Результаты позволяют достоверно отличить высокий риск от низкого, в том числе и в российской популяции. Авторы также посмотрели корреляции генетических предикторов с биомаркерами в ликворе — бета-амилоидом и тау-белком — и для последнего корреляцию удалось обнаружить. Для этого чипа также начали регистрацию.
Затем Дмитрий Александрович рассказал о детекции аутоантител у пациентов с аутоиммунными заболеваниями — по сути, это адаптация ИФА-метода для биочипов, которые в этом случае содержат иммобилизованные аутоантигены. Создан биочип для выявления аутоантител при аутоиммунном полигландулярном синдроме I типа, первичной надпочечниковой недостаточности, аутоиммунных заболеваниях щитовидной железы, сахарном диабете I типа. При тяжелом течении COVID-19 появляются антитела к интерферонам I типа; частота выявления таких антител резко возрастает у людей после 70 лет.
Интересно, что аутоантитела могут быть и у здоровых людей, но, например, авидность антител к тиреопероксидазе и тиреоглобулину, если они обнаруживаются у клинически здоровых, ниже, чем у больных с выраженными симптомами аутоиммунного тиреоидита. Это тоже удалось установить с помощью биочипов.
Инновационную технологию point-of-care диагностики представила Елена Кошель (Национальный исследовательский университет ИТМО, Санкт-Петербург) — детекцию любых ДНК и РНК маркеров с помощью ДНК-наносенсоров, в которых используются, во-первых, шпилечные структуры, во-вторых, рибозимы — иными словами, нуклеиновые кислоты, но не белки.
Сотрудники ИТМО известны как «цифровики», чемпионы мира по программированию, отметила Елена Ивановна, но биомедицине все чаще нужен анализ больших данных, искусственный интеллект и другие цифровые технологии, так что «непрофильная» для университета биология все чаще появляется в тематике исследований.
Технология ДНК-наносенсоров с 2021 года прошла путь от лабораторной диагностики до компактных приборов; следующая цель, которая будет достигнута в 2025 году, — карманный микрофлюидный тест-полоска, доступный любому неквалифицированному пользователю. Сейчас тесты работают на изотермике, и задача в том, чтобы уйти к безамплификационным тестам, сохранив селективность и чувствительность.
Существует три варианта детекции: цветная, похожая на всем знакомую пероксидазу, флюоресцентная и реологическая (основанная на полимеризации раствора). Создан программный продукт DNSorder для разработки новых ДНК-сенсоров.
Система всегда включает два компонента, но они могут дополняться вспомогательными элементами — «платформами», «руками», — чтобы релаксировать сложную матрицу, расплетать двухцепочечную ДНК и т.п.
Сложная структура с дополнительными «руками» для связывания с аналитом используется в безамплификационной системе детекции; она позволяет накапливать сигнал. Для анализа нужно лизировать культуру клеток, провести гибридизацию с зондом, провести детекцию на флуориметре — и это всё. Таким способом выявляются даже отличия в один нуклеотид, подчеркнула Елена Ивановна. Пока что метод испытывается на культурах клеток и может быть альтернативой FISH. Он также может использоваться для детекции вирусов — как альтернатива количественной ПЦР.

Два сенсора в системе, дающие разные цвета, — «биплексная дезоксирибозимная наномашина», или bixDNM — может использоваться для детекции аллелей, например, для гаплотипирования ячменя.
Помимо новых ДНК-наносенсоров, в ИТМО разрабатывают новые методы детекции (магнитная количественная детекция, визуальная детекция) и новые инженерные решения. В частности, по заказу ФМБА России создают решение для быстрой (за 1,5 ч) point-of-care диагностики инфекций ЦНС по ликвору. В 2022 году материалы переданы заказчику для технических и клинических испытаний.
Технология может быть адаптирована к любой жидкости, любому списку патогенов с матрицей любой сложности. «Любой молекулярный вызов для нас интересен», — говорит Елена Кошель.
Независимая от праймеров амплификация — звучит непривычно, но именно такой была тема доклада Дениса Набережнова (ЦСП ФМБА России). Он напомнил, что амплификация, как бы там ни было, остается непревзойденной по чувствительности и универсальности. Опосредованная шпилькой, независимая от праймеров изотермическая амплификация (HAIR) рассматривается как потенциальный метод ДНК-диагностики, хотя пока это больше концепция, чем методика, отметил Денис Сергеевич.
Парвовирусы изобрели амплификацию, опосредованную Т-образными шпильками, много лет назад. Адаптировать ее для практических применений непросто, но благодаря высокой скорости амплификации и потребности в праймерах только на стадии инициации она представляется перспективной.
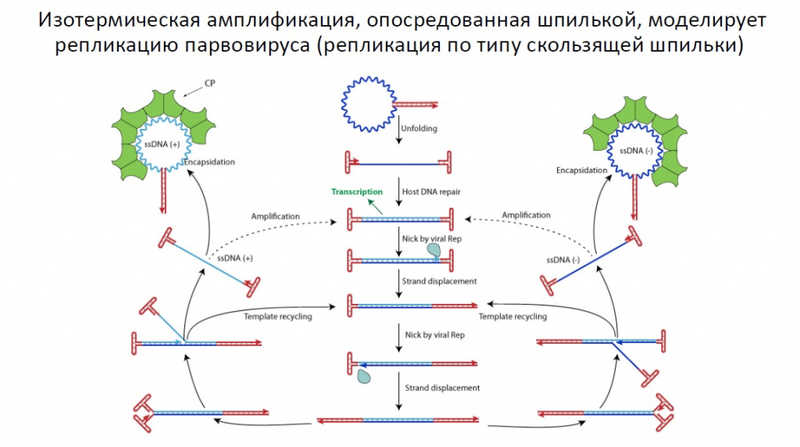
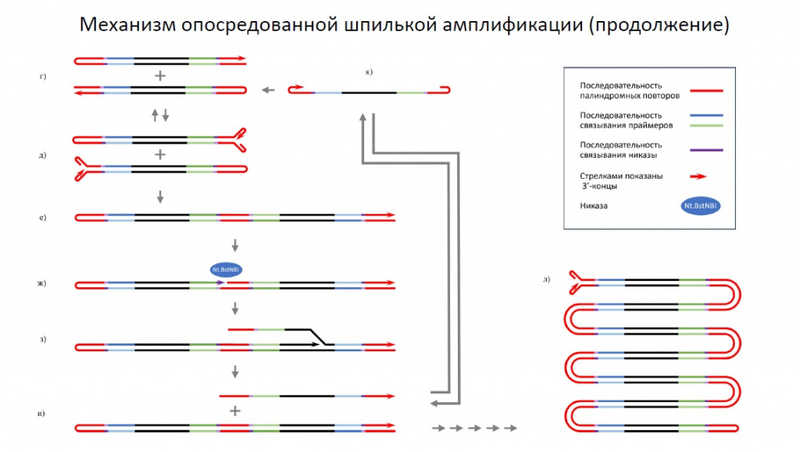
Реализовать природный методы в виде изотермической амплификации, готовой к применению в лаборатории, непросто. Чтобы амплификация шла быстро, концевые повторы делают из АТ-богатых палиндромов. Однако при удлинении цепи реакция замедляется, и для противодействия этому эффекту в реакционную смесь добавляют никазу, которая делает одноцепочечные разрывы. В результате начинается ветвление и экспоненциальный рост количества продукта.
Преимущества технологии — высокая скорость (в 4-5 выше скорости LAMP), потребность в праймерах только на начальном этапе и механизм инициации, отличный от механизма самой реакции. Но есть и недостатки. При обычной амплификации праймеры оказывают давление на амплификацию, направляя синтез нужного продукта. А самоамплифицирующийся продукт предоставлен самому себе, и это не всегда хорошо. В заключение Денис Сергеевич выразил надежду, что на следующей конференции сможет рассказать про более значимые результаты, полученные с помощью HAIR.
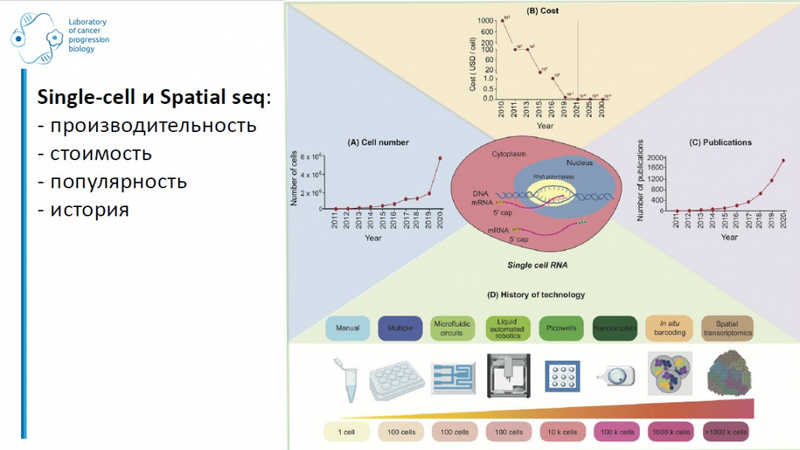
Евгений Денисов (НИИ онкологии Томского НИМЦ, Томск; НИИ молекулярной и клеточной медицины Медицинского института РУДН, Москва) рассказал о том, как single-cell анализ и пространственная транскриптомика совершили революцию в фундаментальных исследованиях и дали старт «прецизионной медицине 2.0». Эти подходы дают возможность при NGS-исследованиях получать вместо «усредненных» данных по образцу конкретную информацию по ДНК и РНК единичных клеток, а в случае пространственной транскриптомики — дополнять ее информацией о локализации клетки.
На современном этапе развития технологий мы можем анализировать сотни и миллионы клеток, при этом стоимость анализа одной клетки – несколько рублей. Разнообразие вариантов методики, доступных исследователям, огромно.
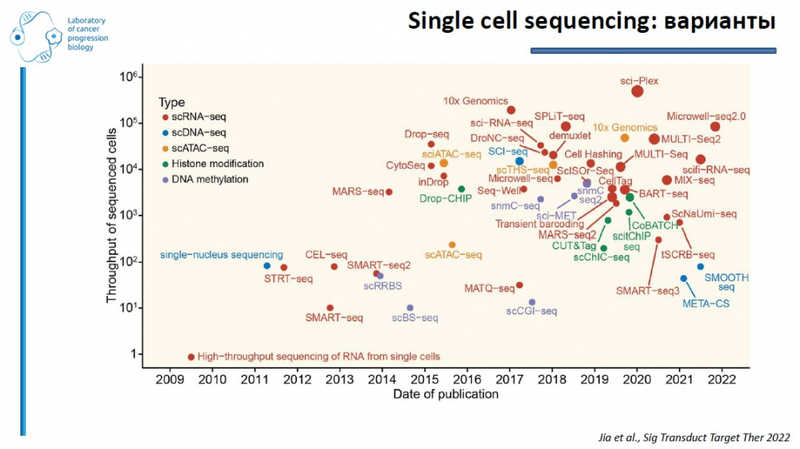
Ценность секвенирования единичных клеток еще и в том, что один метод исследования дает много разнообразной информации, подчеркнул докладчик. Эти технологии использует проект Human Cell Atlas, в котором участвуют российские ученые. Его задачи — типировать каждую клетку человека, идентифицировать новые типы клеток и создать новое понимание их функций. Аналогичные проекты есть для макаки-крабоеда, дрозофилы и других модельных объектов. Существует телеграм-канал с новостями из мира single-cell analysis.
Евгений Владимирович также представил результаты своих с коллегами проектов, поддержанных грантами РНФ. Один из них посвящен пространственной транскриптомике рака полости рта. Заболеваемость им за последние три десятилетия выросла почти вчетверо, он встречается в том числе у некурящих молодых людей, не инфицированных ВПЧ, и может быть крайне агрессивным. Арсенал эффективных терапевтических средств быстро заканчивается, поэтому нужны новые подходы. Пространственная транскриптомика позволила получить кластеры для молодых и возрастных (старше 45 лет) больных, найти клетки-родоначальники. Отличительные черты рака языка у молодых пациентов — окислительный стресс, активация пути МАРК, сосудистая мимикрия, иммуносупрессия.
В рамках другого проекта изучается динамика иммунной системы при химиотерапии рака молочной железы — исследуются как клетки крови, так и биопсийные образцы. Результаты позволяют сделать выводы, что химиотерапия подавляет врожденный иммунный ответ и стимулирует адаптивный иммунный ответ, в том числе гуморальный (количество В-клеток резко возрастает, потом падает); увеличивает число М2 макрофагов, определяющих сигналинг иммунного ответа, и Т-регуляторных клеток, снижает количество цитотоксических Т-клеток и NK.
Третий проект — изучение циркулирующих опухолевых клеток (ЦОК) и гибридных клеток при РМЖ, то есть поиск клеток, которые дают метастазы. Проточная цитометрия плохо справляется с этой задачей. ЦОК оказались высокогетерогенными, среди них есть как диплоидные, так и анеуплоидные, а среди анеуплоидных удалось найти агрессивную популяцию клеток, которые, возможно, и являются родоначальниками метастазов. Среди гибридных клеток, которые формируются при слиянии опухолевых клеток с иммунными (докладчик назвал их «уродами-суперменами»), преобладают диплоидные, так что анализ плоидности может быть эффективным инструментом для идентификации опухолевых и гибридных клеток. Чтобы точнее определить, какие кластеры наиболее опасны, нужны дальнейшие исследования.
Еще один новый для клинической медицины подход — диагностику на основе анализа микроРНК – представил Антон Пушкин (Химико-биологический кластер, SCAMT Institute, Санкт-Петербург).
Циркулирующие миРНК присутствуют везде, ассоциированы со всеми болезнями и состояниями, физической активностью, возрастом, полом, сказал Антон Андреевич. Но для диагностики необходимы адекватные, стандартизированные методы анализа, а анализ начинается с выделения и очистки. миРНК могут находиться в везикулах или других носителях, быть связанными с белками, с клеточной поверхностью.
Докладчик сделал краткий обзор методов экстракции (классический фенол-хлороформ и в этом случае хорошо себя проявляет) и синтеза библиотек, а также пайплайнов для биоинформатического анализа. Оригинальный подход к синтезу библиотек с использованием адаптеров не лишен недостатков (вариабельная эффективность, образование димеров адаптеров, игнорирование некоторых классов малых РНК, например, мяРНК). Существуют модифицированные варианты, среди которых Антон Андреевич особо отметил безлигазный протокол синтеза библиотек микроРНК. (Конечно, минусы есть и у него, например, он не подходит для изомеров микроРНК.)
Что касается пайплайнов для биоинформатического анализа, Антон Андреевич посоветовал слушателям не пользоваться онлайн-сервисами, а поднять свой пайплайн. Как вариант, можно профильтровать данные большим количеством методов: они дают вариабельные результаты по экспрессии, но есть пул, одинаковый у всех.
Докладчик перечислил компании из разных стран, которым уже удалось коммерциализировать практические приложения анализа миРНК. Hummingbird (Гейдельберг, Германия) исследует экспрессию малых молекул РНК в крови и клетках крови для диагностики рака легкого, рака мочевого пузыря, нейродегенеративных заболеваний, и по отдельным направлениям подходит к клиническим испытаниям. По раку легких удалось получить довольно высокую чувствительность и специфичность. Сингапурская компания Mirxes разрабатывает технологии для скрининга опухолей желудка, проводит большое количество популяционных исследований. Craif (Япония) занимается ранней диагностикой 7 типов опухолей, в том числе опухолей легких, желудка, молочных желез, яичников, поджелудочной железы, пищевода, колоректального рака. Тест уже доступен более чем 500 японских клиниках. Есть и диагностика неопухолевых состояний — у компании TAmiRNA (Австрия) имеется тест для оценки риска печеночной недостаточности после гепатэктомии.
Сам Антон Пушкин с коллабораторами (ИТМО, НМИЦ онкологии им. Н.Н.Петрова) работает над методами микроРНК-диагностики глиобластом. Уже получены данные Fastq для 12 пациентов и 12 здоровых доноров, и соавторы с нетерпением ожидают результатов, которые позволят ответить на вопрос, насколько хороша модель.
Для подтверждения клинической диагностики миРНК-диагностики нужны крупномасштабные стандартизированные исследования, отметил докладчик в заключение, а также более чувствительные методы детекции и интеграция с другими омиксными данными. На мемный вопрос «чего мы хотим?» он дал следующий ответ: «GR-поддержку, денег и образцы!»
Вероника Алексеевна Романова (Департамент здравоохранения Москвы) рассказала, как организован и работает Московский геномный центр, где секвенируют геномы возбудителей респираторных заболеваний. В практику столичного здравоохранения внедряются современные методы надзора за микроорганизмами. Подход на основе NGS позволяет быстро определить, что за «простудой» болеют москвичи, как коронавирус или грипп сменяются риновирусом в теплое время года, выявить преобладающий штамм во время подъема заболевания.
Одно из ключевых преимуществ подходов на основе NGS в том, что они, в отличие от ПЦР-методов, не требует предварительного знания геномных последовательностей, то есть подходят для идентификации неизвестных патогенов. Кроме того, полный анализ генома дает информацию об эволюции патогена, мутациях устойчивости и других важных характеристиках.
В Москве на базе ГБУЗ «ДЦЛИ ДЗМ» в октябре 2022 года начал работу единый центр мониторинга эпидемических значимых респираторных инфекций, в 2023 году организован Московский геномный центр.

Помимо регулярного мониторинга и контроля заболеваемости, в МГЦ предполагается и научная деятельность, в том числе участие в КИ.
В Центре ведется ПЦР диагностика гриппа, коронавируса SARS-CoV-2, 13 возбудителей ОРВИ. Детальный анализ генетического материала с помощью NGS проводится для вирусов гриппа и SARS-CoV-2, в планах — возбудители ОРВИ.
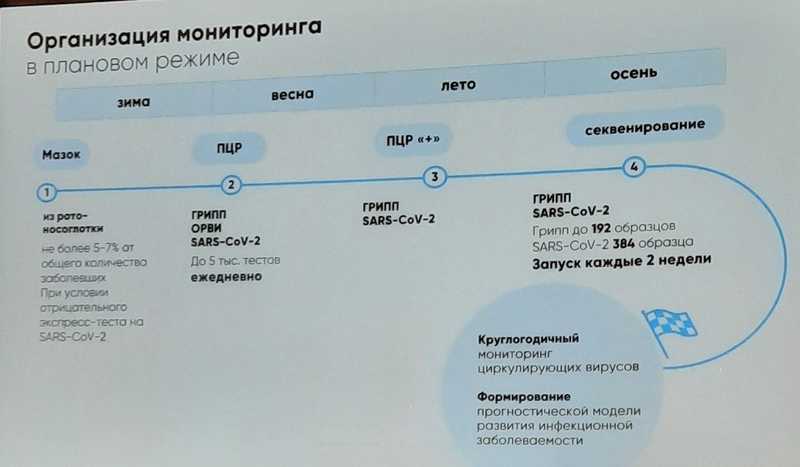
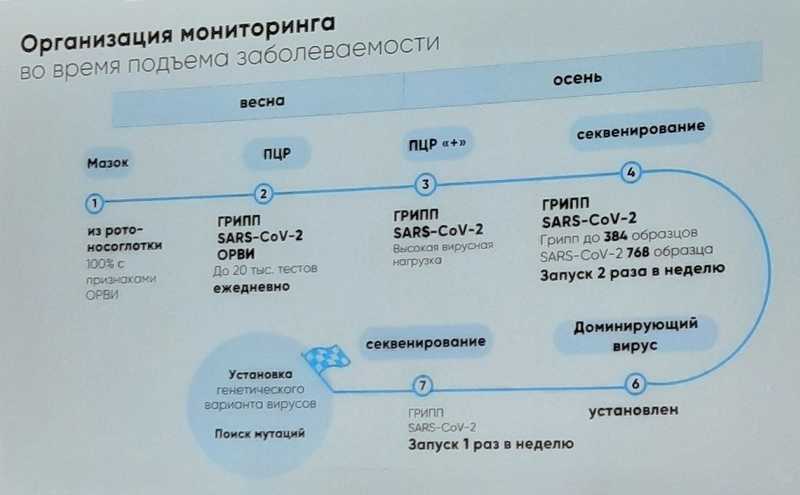
Так, NGS-анализ в августе-октябре 2023 года выявил присутствие определенных штаммов вирусов гриппа А и В, вызывающих сезонные вспышки заболевания. Процент штаммов ХВВ SARS-CoV-2 в октябре оставался высоким и относительно стабильным. Мониторинг с ноября 2022 года по май 2023-го показал, что разные штаммы гриппа циркулируют в Москве не одновременно, а сменяют друг друга.
Информация о докладчиках
Агина Елена Валериевна, д.х.н., зам. директора по науке Института синтетических полимерных материалов им. Н.С. Ениколопова РАН, руководитель лаборатории молекулярных сенсорных технологий отдела органической электроники, профессор факультета фундаментальной физико-химической инженерии МГУ им. М.В. Ломоносова
Грядунов Дмитрий Александрович, д.б.н., зав. лабораторией технологий молекулярной диагностики Институт молекулярной биологии им. В.А. Энгельгардта РАН (Москва)
Кошель Елена Ивановна, к.б.н., доцент, руководитель лаборатории ДНК-наносенсорной диагностики Национального исследовательского университета ИТМО (Санкт-Петербург)
Набережнов Денис Сергеевич, к.б.н., лаборатория разработки новых методов молекулярной диагностики заболеваний человека ФГБУ «Центр стратегического планирования и управления медико- биологическими рисками здоровью» ФМБА России, Москва
Денисов Евгений Владимирович, д.б.н., зав. лабораторией биологии опухолевой прогрессии НИИ онкологии Томского НИМЦ, Томск; зав. лабораторией единичных клеток НИИ молекулярной и клеточной медицины Медицинского института РУДН, Москва
Пушкин Антон Андреевич, зав. лабораторией Химико-биологического кластера, SCAMT Institute, г.Санкт-Петербург
Романова Вероника Алексеевна, Департамент здравоохранения Москвы


 Меню
Меню





 Все темы
Все темы



 0
0