Самая быстрая диагностика
Микрофлюидика в России, восстановление спинного мозга после повреждения, гидрогелевый чип для анализа предрасположенности к раку и гигантская рамановская спектрометрия для биосенсоров.

Научно-практическая конференция «Клиническая диагностика и персонализированная медицина», организованная ФГБУ ФНКЦ физико-химической медицины ФМБА России, прошла в Одинцово, в отеле Park Inn. Мы не сможем пересказать все доклады, но хотя бы часть выступлений первого дня представим в этом материале.
Пленарное заседание открыл доклад Владимира Баклаушева, заместителя генерального директора по научной работе Федерального научно-клинического центра ФМБА России, главного внештатного специалиста по клинической лабораторной диагностике ФМБА. Он сделал обзор одного из самых амбициозных направлений современной медицины — регенеративной терапии неврологических заболеваний. В ходе эволюции человек приобрел развитый мозг, но утратил способность к регенерации нервных тканей. В отличие от нас, рыбы и амфибии могут восстановить рассеченный спинной мозг, причем не за счет стволовых клеток, а за счет репрограммирования дифференцированных клеток в районе травмы. Например, при регенерации сетчатки у данио репрограммированные клетки мюллеровой глии асимметрично делятся, возникают новые стволовые клетки и восстанавливают пул нейронов сетчатки. Аналогичным образом, через возникновение глиального мостика, восстанавливается спинной мозг; в этом играет ключевую роль фактор роста соединительной ткани (CGTF). У человека он также экспрессируется при травме, но это приводит к фиброзу, а не к регенерации. Можно предположить, что человек утратил способность регенерировать для защиты от опухолеобразования; с другой стороны, аксолотли и данио раку не подвержены.
 Владимир Баклаушев
Владимир Баклаушев
Функции нейральных стволовых клеток человека связаны в основном не с регенерацией после повреждения, а, например, с приобретением новых навыков (см. об этом обзор В.П.Баклаушева с коллегами). Сегодня ремоделирование матрикса с репрограммированием клеток представляется более перспективным направлением терапии повреждений ЦНС. В экспериментах на мышах таким способом уже получают разные типы клеток. В будущем, возможно, удастся стимулировать репарацию повреждений репрограммированием клеток in situ, прямо в организме. Подобные эксперименты проводились на мышиной модели паркинсонизма: из астроцитов были получены новые дофаминергические нейроны в черной субстанции.
Затем докладчик рассказал о собственных работах по репрограммированию фибробластоподобных клеток в клетки-предшественники нейронов и созданию тканеинженерных конструктов для терапии спинальной травмы у приматов. Клетки-предшественники, полученные у самого животного, в место травмы пересаживают в матриксе из фибринового геля, спидроина или хитозана. В прошлом году сотрудники Северо-Западного университета (США) опубликовали в Science статью о «танцующих молекулах» (dancing molecules) — это подвижные пептиды в составе матрикса; благодаря подвижности они имеют высокую аффинность к рецепторам и ускоряют регенерацию спинного мозга. Подобные мотивы можно конъюгировать и со спидроином, отметил Владимир Баклаушев.
Возможны также комбинированные подходы: пересадка клеток в матриксе в сочетании с электростимуляцией. Мы недавно писали о работе швейцарского нейробиолога Грегуара Куртина с коллабораторами, которые выяснили, почему эпидуральная электростимуляция возвращает подвижность травмированным мышам и людям: оказывается, при этом активируется особая популяция интернейронов. Можно ли с помощью электростимуляции активировать нейроны в тканеинженерной конструкции? Чтобы ответить на этот вопрос, докладчик с коллегами проводят опыты на приматах.
Директор Института аналитического приборостроения РАН Анатолий Евстрапов рассказал о микрофлюидных технологиях в биотехнологических приборах. Микрофлюидика начала развиваться в 1990-х годах. Одним из пионеров направления был Андреас Манц, который разрабатывал концепцию микросистемы полного анализа (μ-TAS), или «лаборатории на чипе» (lab-on-a-chip). Основные тенденции — миниатюризация (сейчас появились даже нанофлюидные системы); автоматизация, без которой процессы в микропространстве невозможны; машинное обучение для интерпретации данных; использование гибридных технологий; упрощение процесса для пользователя и, наконец, мультиплексирование, то есть одновременное определение разных мишеней, максимизация информации, которую можно получить от одной пробы.
На микрофлюидном чипе размером в несколько квадратных сантиметров имеются устройства для разделения образца, движения потоков жидкости, лизиса и выделения белка либо НК, проведения специфических реакций и детектирования. Одна из важных задач микрофлюидики — диагностика у постели пациента, в местах оказания медицинской помощи (point-of-care, или POC), а не в специализированной лаборатории. Медицинские направления микрофлюидики, в том числе и РОС, хорошо финансируются. При этом выживаемость стартапов на данном направлении в США — 75%, в РФ, по имеющимся данным, около 10%.
Микрофлюидные устройства для РОС и других медицинских применений — это микрофлюидика на бумаге и других пористых материалах, на чипах и на дисках (последние используют центрифугирование для прокачки жидкости). К «бумажной» микрофлюидике относятся как тест-полоски, или анализ в латеральном потоке, так и «лаборатории на бумаге» (более сложная система).
Требования к РОС, сформулированные зарубежными регуляторами, достаточно жесткие: доступность для потребителя, чувствительность и специфичность, сравнимые с лабораторными тестами, простота и удобство, быстрота, надежность, отсутствие потребности в специальном оборудовании. Некоторые эксперты добавляют, что система РОС не должна потреблять энергии, но такому критерию удовлетворяют разве что тест-полоски, у которых проблемы с другими критериями. Желательно обеспечить получение информации в реальном времени и простоту сбора образца, а также длительное время хранения при комнатной температуре.
По аналитическим критериям РОС, конечно, не превосходят лабораторные, но преимущества быстроты и доступности для неспециалистов очень важны.
С ценовой доступностью тоже непросто. «Лаборатория на чипе — сложная система, и она не может стоить копейки или рубли, десятки или даже сотни рублей», — говорит Анатолий Евстрапов. От более простых систем она отличается тем, что в ней можно менять условия тестирования, параметры реакции и получать дополнительные результаты, но это требует более высокой квалификации. Такие разработки могут быть востребованы в военных и космических исследованиях. Докладчик подчеркнул, что и разработка внешне простых тестов, таких как полоски, требует значительных усилий, поэтому совсем бесплатными они тоже быть не могут. Желательная стоимость теста РОС оценивается в $5-10 долларов, прибора — не более $500.
Разработка быстрого теста — длительный процесс, который требует маркетингового анализа, дизайна, расчета конструкции, оценки возможностей производства, патентное исследование. На все это при любых условиях уходит 3–5 лет. Но самое главное, с точки зрения разработчика — взаимодействие с потребителем, готовность оговаривать все нюансы.
Докладчик также рассказал о том, какие технологии изготовления пластиковых изделий можно применять на этапах разработки и предварительных испытаний чипов, а какие позволят сделать систему недорогой при серийном производстве (полномасштабное испытание — это уже 5–10 тысяч.) Многие задачи РОС — считывание и анализ результатов теста, передача данных в облако или медицинскую организацию для консультации со специалистом — можно решить с помощью смартфона, в который установлено специальное приложение.
Немаловажный вопрос — стандартизация микрофлюидики. Есть организация, которая продвигает разработки, находит спонсоров и т.д., у российских разработчиков связи с ней сохраняются. Она хороша тем, что помогает решать проблему стандартизации: хоть и медленно, но работает над стандартами.
Докладчик упомянул зарубежные разработки в области РОС, таких как GeneXpert, тест Abbott на коронавирусную инфекцию, и выразил сожаление, что в России таких тестов нет. Во время дискуссии было высказано предположение, что ситуацию может улучшить признание изотермической амплификации в качестве альтернативы ПЦР для медицинского тестирования. Тесты на основе LAMP сейчас могут получить регистрационное удостоверение (РУ), но клинические лаборатории не готовы их использовать. Анатолий Евстрапов согласился с этим мнением и сказал, что они сейчас пытаются вести работы в этом направлении вместе с АО «Синтол»: «Они выпустили тест на ковид (очевидно, речь о «АмплИзо-SARS-CoV-2» — PCR.NEWS) и теперь пытаются его провести через все бюрократические препоны». Уже есть несколько таких российских тест-систем, и, возможно, разработчики общими усилиями смогут продвинуть LAMP.
Отвечая на вопросы, когда удастся «импортозаместить» детектирующую часть, докладчик сообщил, что системы для обработки данных и передачи в облако развивают уже сейчас, и они будут применяться в приборе для секвенирования путем синтеза. С элементной базой сложно, так, фотоприемные устройства используются китайские. Однако для простых РОС элементная база есть. Возможно наладить производство процессоров, если производители не будут «заняты другими заказами».
 Евгений Горский (слева) и Анатолий Евстрапов
Евгений Горский (слева) и Анатолий Евстрапов
Секцию «Новые платформы для диагностики» открыл Евгений Горский, генеральный директор ООО «Троицкий инженерный центр», докладом о внелабораторной диагностике инфекций методом ПЦР. По его мнению, в России не все так плохо с микрофлюидикой: есть предпосылки к появлению отечественных приборов на рынке.
«Троицкий инженерный центр», который представляет докладчик, — это приборостроение полного цикла, «от физики до производства и сервиса»; компания производит технику для полупроводниковой отрасли и для медицинской диагностики. Есть и участок микрофлюидики, где делают пластиковые чипы.
Разнообразные существующие решения для ПЦР диагностики в формате РОС докладчик рассортировал по различным параметрам. По предназначению — для использования в медучреждении или на дому; по типу амплификации (обычная ПЦР с термоциклированием или изотермические методы, такие как LAMP); по принципу детекции (классическая флуоресцентная детекция, а также колориметрическая, электрохимическая и даже визуальная регистрация результата на тест-полосках). Другие важные параметры — количество одновременно исследуемых мишеней, количество образцов, тип биоматериала, условия хранения расходников (реагенты для обычной ПЦР хранятся в морозилке, тогда как лиофилизированные реагенты могут долго храниться при комнатной температуре) и наконец, стоимость прибора и тестов.
Еще одна группа параметров, особенно критичная для дешевых вариантов, — метод выделения НК, лизиса и инактивации пробы. Простейший вариант — вообще не проводить экстракцию. Возможны также химический, термический лизис, микроколонки или сорбция на мембране. В лабораторных условиях используется экстракция на магнитных частицах, иногда она применяется и в РОС-формате. От метода экстракции зависит, какие могут использоваться биоматериалы. Самые простые в этом плане — респираторные мазки, смывы. Более сложные, требующие серьезной очистки, — кровь, мокрота и кал.
Далее докладчик рассказал про некоторые приборы, имеющиеся на рынке. Тест-прибор компании Lucira Health (США) — одноразовый, после измерения устройство, работающее на батарейках, выбрасывается. Сначала был создан тест Lucira на COVID-19, недавно одобрен для использования в медучреждениях аналогичный тест, одновременно детектирующий COVID-19 и грипп. Цена превышает $70 долларов, зато тест показывает высокую чувствительность и специфичность. Есть много подобных приборов китайского производства, например Pluslife (изотермическая амплификация, флуоресцентная детекция, сухие реагенты, возможность определять три инфекции за один раз и достаточно широкая линейка тестов). Сам прибор стоит $300 долл., картридж тоже доступный по цене.
Более сложное решения — казанский прибор EMG LifePad, использующий технологию амплификации SmartAmp, разработанную в Японии (см. публикацию 2020 года на PCR.NEWS). Экстракция нуклеиновых кислот происходит на мембране, детекция флуоресцентная, стоимость картриджа — около $30, серийное производство картриджей налажено в Казани. Одновременно можно определять до двух мишеней, и авторы работают над расширением линейки. Аналогичные приборы в других странах — CleoOne (Япония) и Aidian (Финляндия).
Самые сложные приборы — с полноценной экстракцией, колоночной либо на магнитных частицах, обеспечивают точность и качество как у лабораторных ПЦР-анализов. В России у специалистов по туберкулезу популярны анализы GeneXpert от Cepheid; компания предлагает картриджи для определения наличия микобактерий и чувствительности к рифампицину. Докладчик также упомянул продукцию bioMérieux и корейской компании SD Biosensor.
Среди российских продуктов — ПЦР-амплификатор для РОС «Биоэксперт» (подробнее на PCR.NEWS). Прибор, разработанный в ФНКЦ ФХМ, использует изотермическую амплификацию. Оба устройства имеют РУ.
Также Евгений Горский рассказал о новых разработках «Троицкого инженерного центра». В будущем году планируется регистрация «карманного» изотермического амплификатора с колориметрической детекцией. В 2021 году начата разработка прибора «в стиле GeneXpert», включающего пробоподготовку. Реагенты делают исследователи из Центра стратегического планирования ФМБА РФ, Троицк отвечает за инженерную часть. «В картридж помещается мазок, дальше все автоматически. Надеемся получить стоимость картриджа 1,5–2 тысячи рублей», — сказал докладчик.
Дмитрий Грядунов, заведующий лабораторией технологий молекулярной диагностики Института молекулярной биологии им. В.А. Энгельгардта РАН сообщил о новых успехах гидрогелевых биочипов (презентация в pdf). Биочипы — это не РОС, а лабораторная технология, но она успешно себя зарекомендовала.
Идею гидрогелевых биочипов начал развивать академик А.Д. Мирзабеков, который возглавлял ИМБ после Энгельгардта. В полусферических гидрогелевых элементах диаметром 50–100 мкм на подложке иммобилизованы зонды — фрагменты ДНК, белки, гликаны и даже клетки. У этого решения много плюсов. В гидрогеле у зондов одинаковая энергия связывания, кривые диссоциации крутые, поэтому можно подобрать температуру, когда совершенный комплекс стабилен, а несовершенный нет. Гибридизация позволяет различать однонуклеотидные замены. Белки в трехмерной матрице сохраняют свои структуры. У гидрогелевых полусфер высокая емкость иммобилизации — в тысячи раз больше молекул, чем на планарной подложке, что позволяет делать недорогие приборы для флуоресцентной детекции. Наконец, биочипы хранятся годами.
 Дмитрий Грядунов
Дмитрий Грядунов
Принцип производства биочипов прост: на поверхности пластика есть оксидные группы, после нанесения гидрогеля производится УФ-облучение, идет совместная полимеризация, ковалентные связи пришивают гель к поверхности. Производство полностью локализовано в России, подчеркнул докладчик.
Одно из главных приложений биочипов — детекция инфекционных микроорганизмов. В самом начале, около 15 лет назад, перед разработчиками поставили задачу: научиться детектировать лекарственно-устойчивые (ЛУ) формы туберкулеза. В ноябре 2004 года был зарегистрирован биочип для выявления ДНК микобактерии и определения ее устойчивости к рифампицину и изониазиду; его модификации используются и сейчас. Однако «микобактерия тоже не стояла на месте», заметил Дмитрий Грядунов: в 2005 году среди впервые выявленных больных ЛУ форму имелись у 15%, в 2015-м — более чем у половины. Совместно с ФНКЦ ФХМ был сделан тест следующего поколения, выявляющий одновременно 120 детерминант устойчивости. (Для выявления нуклеиновых кислот пока необходима предварительная амплификация.)
Другой пример — гонококковая инфекция. Нейссерия любит использовать мобильные элементы для передачи устойчивости, и это большая проблема. Как показало исследования 600 изолятов со всей РФ, устойчивость к цефтриаксону у нас еще не распространилась, но ко многим старым препаратам, она есть.
Существуют и биочипы для анализа генома человека, прежде всего чип, на который получили РУ в этом году: «Некая гордость, для ученых вообще получение РУ — это всегда как на Эверест взойти», — сказал Дмитрий Грядунов. «ГЕРДА-БИОЧИП» позволяет выявлять 23 мутации предрасположенности к раку молочной железы, раку поджелудочной железы и раку яичников. Биочипы также могут использоваться для оценки эффективности препаратов платины и ингибиторов пролиферации у конкретного пациента.
Задача, решенная совместно с Алексеевской больницей в Москве и НМИЦ психиатрии и наркологии им. В.П. Сербского — биочип для определения полигенного риска развития деменции Альцгеймерского типа по 21 маркеру.
На биочипах можно выполнять и мультиплексные иммунные анализы. В полусферах иммобилизуются антигены либо антитела, на чип наносится образец, затем вторичное антитело с меткой, и проводится регистрация флуоресценции. Совместно с НМЦ эндокринологии МЗ РФ удалось решить задачу детекции маркеров аутоиммунных эндокринных патологий, таких как сахарный диабет 1 типа, аутоиммунный тиреоидит. Кроме того, исследователи нашли триплет антител, который со специфичностью почти 100% характеризует аутоиммунный полигландурлярный синдром 1 типа — редкое моногенное заболевание. Аналогичным образом можно создавать биочипы для детекции антител — маркерам тяжелого течения коронавирусной инфекции и, конечно, биочипы с антителами к вирусам.
(Еще о биочипах из ИМБ — в интервью 2019 года с Дмитрием Грядуновым.)
Почти все существующие методы детекции, будь это ИФА, ПЦР или микрочипы — по сути оптические. Для детекции оптического сигнала можно использовать рамановскую спектроскопию, или спектроскопию комбинационного рассеяния. Этой теме был посвящен доклад Владимира Кукушкина (Институт физики твердого тела имени Ю.А. Осипьяна РАН, ООО «Фотон-Био»).
 Владимир Кукушкин
Владимир Кукушкин
Рамановская спектроскопия основана на том, что при взаимодействии лазерного излучения с веществом в спектре рассеянного света появляются компоненты, сдвинутые на характерные частоты внутримолекулярных колебаний. По положению этих частот, по соотношению интенсивностей линий можно распознавать вещества, сравнивая спектры с базой данных. В группе компаний «Фотон-Био» разрабатывают спектрометры, которые применяются в химической промышленности, фармацевтике, биомедицинских приложениях, а также для решения задач, связанных с безопасностью, и для анализа различных контрафактных материалов на таможне.
Метод хорошо работает с чистыми веществами, при снижении концентрации вещества в образце возникают сложности. На стекле такие вещества прозрачны для лазерного излучения, однако увеличения сигнала можно добиться, если поместить образец на наноструктурированную поверхность, где есть границы раздела металла и диэлектрика. Примером могут служить наноостровковые серебряные частицы на поверхности кварца. Изменяя морфологию наночастиц, можно управлять пиком плазмонного поглощения и подстраивать оптические свойства под нужную волну лазерного излучения.
Из-за сложного строения биомолекул возникает спектральная перегруженность, поэтому, чтобы добиться специфичности биосенсора, сочетают эффект поверхностного усиления рамановского рассеяния с аптамерными технологиями. Аптамеры — функциональные аналоги антител, которые тоже узнают эпитопы на поверхности биомолекул, но в отличие от антител, дешевы и легко модифицируются. Например, в сенсоре для детекции вируса гриппа на металлизированной подложке находятся тиомодифицированные аптамеры, а после нанесения контрольного и опытного образца добавляют меченые аптамеры, таким образом детектируется не сигнал вируса, а значительно более сильный сигнал метки. Тест выполняется за пять минут и выявляет разные штаммы. Создан и тест на коронавируса SARS-CoV-2 с пределом обнаружения 100 копий генома на миллилитр (что сравнимо с хорошими ПЦР-тестами) и временем детекции 10 минут.
Итак, преимущества детектирования молекулярных объектов с помощью рамановской спектроскопии — возможность создания мультиплексных систем для детекции различных мишеней на одном чипе («Мы сейчас как раз над этим работаем», — подчеркнул докладчик), дешевизна, высокая чувствительность.
На секции «Point-of-care: Lab-on–a-Chip» Дмитрий Багров (биологический факультет МГУ им. М.В. Ломоносова) рассказал о перспективах применения электроформованных мембран в биосенсорах. Речь идет о мембранах, сделанных методом электроспиннинга из полимерных волокон толщиной 10–100 нм (для сравнения, толщина волокон нетканых материалов, применяемых в быту, измеряется микронами — десятками микрон). Процессы, которые обычно происходят на донышке лунки планшета, могут происходить на мембране, если закрепить на ней рецепторы, связывающие аналит. Мембрану можно использовать не только как вкладку в планшет (докладчик привел пример с определением вируса денге методом, похожим на ИФА) или подложку для микрофлюидного чипа. Можно улучшить чувствительность анализа, проведя фильтрацию. Поры в мембране достаточно малы, чтобы задерживать бактерии, тогда как внеклеточные везикулы и, очевидно, вирусы сквозь них проходят.
 Дмитрий Багров
Дмитрий Багров
Дмитрий Нечипуренко (физический факультет МГУ) представил концепцию простого микрофлюидного устройства для оценки гемостаза. При повреждении сосуда действуют разные механизмы остановки кровотечения: первичный, или «белый тромб» (к коллагеновым волокнам, обнаженным в результате повреждения, приклеиваются тромбоциты) и вторичный, или «красный тромб» (собственно свертывание крови, в результате которой образуется фибриновая сетка, включающая эритроциты). Процесс формирования тромба очень сложен, но простой метод in vitro диагностики не должен воспроизводить его во всех деталях. Докладчик с коллегами создали микрофлюидную модель тромбоза: каналы на чипе пересекают полоску коллагена, и на ней образуются тромбоподобные структуры, когда через каналы прокачивается кровь. Оценив площадь покрытой тромбами поверхности, можно прогнозировать нарушения гемостаза, риски кровотечения или тромбоза и составить план дальнейшего исследования пациента.
 Дмитрий Нечипуренко
Дмитрий Нечипуренко
Одно из возможных применений этого микрофлюидного устройства — изучение гемостаза в «коктейлях», которые составляют для пациентов с редкими группами крови из эритроцитарной массы, плазмы и тромбоцитов. Задача будущего — сделать тест прикроватным: сейчас для него нужен забор крови, который может осуществлять только медработник, а также механика для создания потока жидкости и микроскоп для детекции.
Татьяна Ведехина (ФНКЦ физико-химической биологии ФМБА России) рассказала о белковых микрочипах с белками коронавируса SARS-CoV-2 для профилирования антительного ответа у вакцинированных и переболевших. На стекло, модифицированное аминосиланом, пришивали рекомбинантные белки SARS-CoV-2 (помимо «уханьского» штамма, были представлены каппа, дельта и омикрон). Чипы инкубировали с сыворотками переболевших COVID-19, привитых российскими вакцинами «Спутник V» и «Ковивак», а также с сыворотками здоровых доноров (образцы, взятые до 2018 года). Связывание антител визуализировали флуоресцентно меченными вторичными антителами, результаты анализировали с помощью микроскопа. Несколько повторностей позволяли получить полуколичественную оценку. На чипы наносили как структурные, так и неструктурные белки коронавируса; наиболее выраженное различие сывороток иммунных и неиммунных людей удалось получить для N-белка (точность составила 97%), а также для RBD и S2.
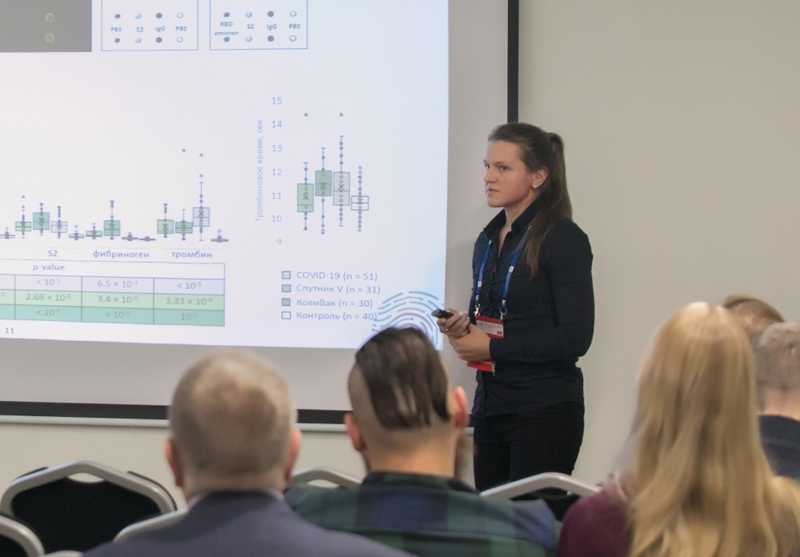 Татьяна Ведехина
Татьяна Ведехина
С результатами исследования можно ознакомиться в публикации авторов. «Спутник V» индуцировал более высокие уровни антител против RBD, чем «Ковивак», однако уровни антител к другим структурным белкам в группе «Ковивак» ожидаемо были выше («Ковивак» — цельновирионная вакцина, а «Спутник» — векторная, несущая ген фрагмента S-белка). Когда авторы аналогичным способом исследовали перекрестную реактивность сывороток переболевших и вакцинированных с человеческими белками, у привитых «Ковиваком» наблюдались антитела к фибриногену, вероятно, из-за некоторых эпитопов, присутствующих только в этой вакцине. Чипы подтвердили хорошо известный факт: иммунный ответ на омикрон у переболевших и вакцинированных снижен, но у привитых «Спутником» снижение было наименее выраженным. К сожалению, свойства чипов ухудшаются, если их хранить при 4 °С; предпочтительнее хранение при -20 °С.
Заключительный доклад д.ф.м.н. Андрея Сарычева, главного научного сотрудника Института теоретической и прикладной электродинамики РАН, был посвящен детекции белков и вирусов методом гигантского комбинационного рассеяния (Surface-enhanced Raman spectroscopy, SERS). От «обычной» рамановской спектроскопии оно отличается тем, что огромное усиление комбинационного рассеяния молекул, адсорбированных на особых наноструктурированных поверхностях, позволяет обнаруживать единичные молекулы.
 Андрей Сарычев
Андрей Сарычев
Андрей Сарычев сравнил принцип комбинационного рассеяния с вентилятором, на который светит лазерный луч. Отраженный луч пульсирует, в спектре Фурье присутствует частота лазерного луча и боковые частоты, которые соответствуют вращению вентилятора. В микромире вентилятор — это конформационные колебания молекул: каждое из колебаний дает спектральную линию. Но сам по себе сигнал конформационного рассеяния слабый, и чтобы его усилить, можно использовать SERS — удивительный эффект, открытый группой Мартина Флейшмана еще в 1970-е.
Резонанс могут обеспечивать иммобилизованные на диэлектрической поверхности металлические наночастицы (например, золотые или серебряные). Когда на такую поверхность помещают измеряемую молекулу, вторичное излучаемое поле увеличивается на порядки. Первые такие локализованные резонансы были обнаружены докладчиком с коллегами в 1999 году, и первоначально частицы на поверхности были расположены случайно.
Андрей Карлович рассказал об эксперименте, который проводился под руководством Ильи Курочкина: хлопья серебра, близкие по размеру к вирусам, располагались на подложке из слюды, и эта система использовалась для детекции вирусов.
Однако в случайных системах электромагнитное поле концентрируется в отдельных точках, молекулы «горят», поэтому сейчас переходят от случайных систем к специально сделанным, с регулярным расположением наноструктур. В качестве примера докладчик рассказал о своей работе, в которой определяли гликированный альбумин (маркер диабета), используя подложку с регулярно расположенными золотыми дисками.
Статья, опубликованная в этом году, представляет метод детекции рецептор-связывающего домена (RBD) S-белка коронавируса SARS-CoV-2. Рекомбинантный RBD иммобилизовали на серебряной поверхности за счет тиольных связей и сверху наносили серебряную пленку, в результате сигнал усиливался. Этот запатентованный метод позволяет обойтись без аптамеров с рамановскими методами, о которых рассказывал Владимир Кукушкин.
Сейчас появилась возможность создавать предсказуемые и доступные подложки, которые дают каскадное усиление электромагнитного поля и могут использоваться в SERS-биосенсорах, подчеркнул докладчик; изготовление подложек для детекции определенных белков «вышло на такой уровень понимания, что это уже не искусство, не рукоделие»; оно достигло технологической зрелости.


 Меню
Меню





 Все темы
Все темы




 0
0








