МД-2023: Новые российские вакцины
Какие действия следует предпринимать при появлении сообщений о новых вариантах коронавируса? Удастся ли создать мРНК-вакцину против гриппа? Когда будет доступна новая вакцина против коклюша и почему она вообще потребовалась? Ответы на эти и другие вопросы — на секции «Возможности создания профилактических препаратов в свете изменчивости патогенных микроорганизмов».

В начале секции Андрей Почтовый, к.б.н., ФГБУ «НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Минздрава России (Москва), прочитал доклад «Изменчивость вируса SARS-CoV-2 как основной драйвер для обновления средств лечения и профилактики».
Вакцинация не смогла остановить пандемию, и с приходом варианта омикрон наблюдается рост заболеваемости (число летальных случаев при этом уменьшается). Основная причина продолжающейся пандемии — изменчивость вируса.
После восьми месяцев циркуляции варианта Ухань (и ему подобных) появились варианты альфа и бета. Они характеризовались единичными мутациями в RBD спайк-белка. Позже появились дельта и омикрон, которые характеризуются гораздо большим количеством мутаций.
Появление каждого нового варианта сопряжено с рисками. Все больше снижается нейтрализующая активность сыворотки крови вакцинированных людей (более чем в 20 раз у омикрона).
Дальше перестали работать моноклональные антитела. Если с приходом бета и дельта это были единичные препараты, то при омикроне произошло повальное снижение эффективности.
Стали появляться данные о снижении эффективности противовирусных препаратов.
В связи с этим необходим постоянный молекулярно-генетический мониторинг циркулирующих вариантов SARS-CoV-2 с пополнением вирусных коллекций и проверкой эффективности препаратов.
В ФГБУ «НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» используется следующий подход. Проводится анализ из всех возможных источников молекулярно-эпидемиологических данных, что позволяет на ранних этапах выявить те варианты, которые начинают появляться и могут оказывать влияние на заболеваемость, госпитализации и смертность.
Далее используется логистическая регрессия, чтобы определить, с какой скоростью новый вариант способен вытеснить доминирующий вариант. Оценивается репродуктивное число.
Это делается еще до того, как новый вариант попал на территорию РФ. Здесь уже можно создавать кандидатные варианты вакцин.
После появлении первых сообщений о заражении на территории России нужно провести оценку вирусной нагрузки у вакцинированных лиц (вирусная нагрузка выше всего была у дельты). Это позволяет понять, насколько вирус контагиозный у вакцинированных людей.
Следующий этап — оценка вирусо-нейтрализующей активности сыворотки. Это позволяет понять, нужно ли менять антигенный состав вакцины. Потом оценивается эффективность специфических противовирусных препаратов.
Показано, что вне зависимости от генетического разнообразия вируса эффективность препаратов не снижается, чего нельзя сказать о моноклональных антителах.
Елена Мазунина, ФГБУ «НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Минздрава России (Москва), прочитала доклад «Потенциал вакцин на основе мРНК-технологии для профилактики сезонного гриппа».
При создании мРНК-препарата первым этапом является конструирование мРНК и клонирование ее в плазмиду, потом трансформация плазмиды в клетки эукариот, наработка, лизис и очистка плазмиды, рестрикция плазмиды, транскрипция в бесклеточных условиях, упаковка в липидные наночастицы.
В ФГБУ «НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» существует действующий лабораторный регламент для изготовления мРНК-препаратов по всем этим этапам. Он позволяет получать препараты, обладающие биологической активностью.
Все начиналось с демонстрации активности вектора, несущего ген люциферазы светлячка. С ее помощью показали proof of concept.
Так, что трансляция начинается уже через 15 минут после введения препарата мышам, а заканчивается на 21-й день. Максимум — на третий день. Наблюдается экспрессия в селезенке, печени, месте введения (до 21-го дня — только в месте введения)
Докладчица рассказала работе своей группы, которая связана с созданием мРНК-препарата, кодирующего гемагглютинины вируса гриппа. При этом она подчеркнула эффективность существующих вакцин от гриппа. Она колеблется в районе 40–60 % в зависимости от эпидсезона.
Ученые закодировали ген гемагглютинина вируса гриппа H1N1 штамма Victoria в вектор и проверили экспрессию на клетках. Затем создали еще две конструкции, которые кодировали гены гемагглютинина вируса H3N2 и вируса B викторианской линии. Получился трехвалентный препарат.
Докладчица продемонстрировала результаты по определению иммуногенности препарата. Был показан ответ мРНК-вакцины.
Потом проверили протективность вакцины на мышах. Им вводили две дозы вакцины, второю — на 14-й день. Спустя 21 день после полной вакцинации мышей заражали гриппом (вирус H1N1, адаптированный к мышам). Через три дня после заражения у трех животных каждой группы были изолированы легкие. На остальных животных изучал выживаемость.
В группе мРНК вирус отсутствовал, а у контролей обнаруживался. В контрольной группе на шестой день погибло около 50% мышей, к девятому дню — 100%.
Между группой мРНК-вакцины и инактивированной вакцины значимых различий нет. В группе инактивированной вакцины погибли три мыши, но это может быть связано с различием в дозах двух вакцин.
В планах группы — исследование возможностей мРНК-технологий для создания препаратов, индуцирующих антитела с широкой нейтрализующей активностью, исследование различных адъювантов, создание животной модели антигенного импринтинга.
Екатерина Рябова, ФГБУ «НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Минздрава России (Москва), прочитала доклад на тему «Применение rAAV для доставки и экспрессии генов тяжелоцепочечных антител и индукции длительной защиты от инфекционных заболеваний».
Аденоассоциированные вирусы (AAV) достигают размеров от 20 до 25 нм. На сегодняшний день идентифицировано около 13 серотипов AAV, это лишь наиболее изученные варианты, выделенные у человека и приматов.
AAV не размножается без вируса-помощника, не вызывает патологических изменений в организме человека. Все это делает его привлекательным для создания на его основе вирусных векторов.
В качестве примера докладчица описала трехплазмидную систему. Первая плазмида несет трансген (ген интереса) и ITR. Вторая плазмида несет гены вируса-помощника. Третья плазмида (пакующая) несет гены Rep и Cap, необходимые для репликации и упаковки. Плазмиды трансфецируются в клетку, где происходит сборка rAAV. Полученный вектор способен трансдуцировать широкий спектр клеток и обеспечивать экспрессию трансгена.
Преимущества rAAV: низкая иммуногенность, безопасность, отсутствие воспалительного потенциала, долговременная экспрессия трансгена.
rAAV часто используют для генной терапии, но также для защиты от инфекционных заболеваний. Есть два подхода: активная иммунизация (создание векторной вакцины) и пассивная иммунизация (доставка генов антител).
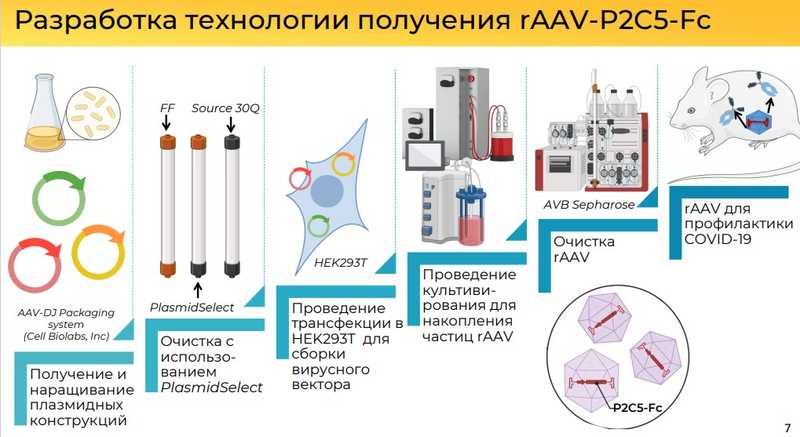
Ранее было получено тяжелоцепочечное антитело P2C5-Fc, обладающее нейтрализующей активностью в отношении различных вариантов SARS-CoV-2. Последовательность этого антитела использовали для создания rAAV-P2C5-Fc.
Было несколько этапов: получение и наращивание плазмидных конструкций (в бактериях), очистка, трансфекция клеток HEK293T для сборки вирусного вектора, культивирование для накопления частиц rAAV, очистка, контроль качества и исследование in vivo.
Подбирали оптимальную дозу препарата для эксперимента на мышах. Доза 2*1011 гк/мышь обеспечивает 100%-ную протективность, начиная с третьего дня после введения без симптомов инфекции. rAAV-P2C5-Fc защищает 100% животных от летальной инфекции SARS-CoV-2 при введении препарата одновременно с заражением, а также при заражении через 24 часа после введения препарата, и 40% — при заражении за 16 часов до введения препарата.
Изучили длительность профилактической активности. Препарат обладал протективной активностью, начиная с первого дня и до 217-го дня. Вирусная нагрузка отсутствовала в органах мышей при инфицировании на 140 день после введения rAAV-P2C5-Fc, в отличие от контрольной группы. Также конструкция защищает от различных вариантов SARS-CoV-2.
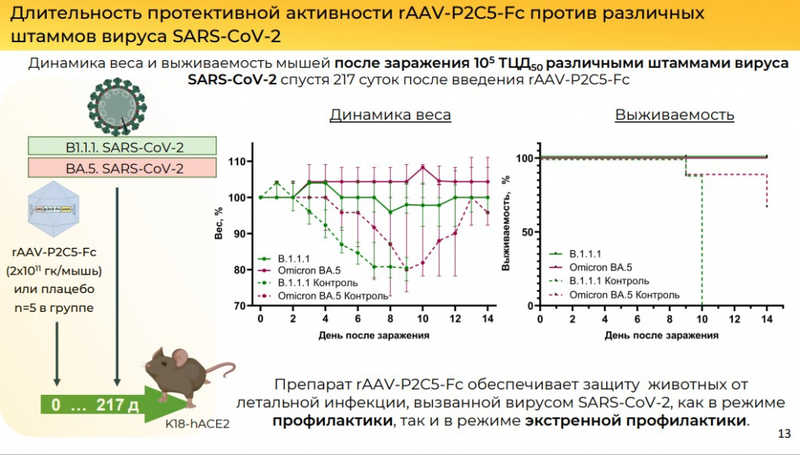
Препарат обеспечивает защиту животных от летальной инфекции в режиме профилактики. Далее исследовали фармакокинетику антитела P2C5-Fc. Препарат способен обеспечивать длительную экспрессию антитела in vivo (более 1 года).
Отвечая на вопрос, докладчица сказала, что проведение КИ препарата не планируется.
Геннадий Каратаев, д.б.н., ФГБУ «НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Минздрава России (Москва), прочитал доклад «Новые коклюшные вакцины в условиях антигенной изменчивости бактерий возбудителя коклюша».
Коклюш называют недоуправляемой инфекцией. Возбудитель известен уже более 100 лет, но до сих пор не до конца понятны патогенез заболевания, механизмы внутреннего ответа, нет «идеальной» вакцины.
Вакцина важна, поскольку практически нет способов лечения коклюшной инфекции. Первой вакциной была цельноклеточная вакцина (ЦКВ), которая содержит инактивированные химическими веществами цельные клетки бактерии B. pertussis. В состав, как правило, водят несколько штаммов бактерии. Однако она обладает некоторой реактогенностью. Примерно 20–30 лет назад создали бесклеточную вакцину (БКВ), которая содержит очищенные отдельные антигены бактерии (аКТ, ФГА, пертактин, фимбрии).
Замена вакцины привела к тому, что во многих странах выросла заболеваемость, особенно у детей до года.
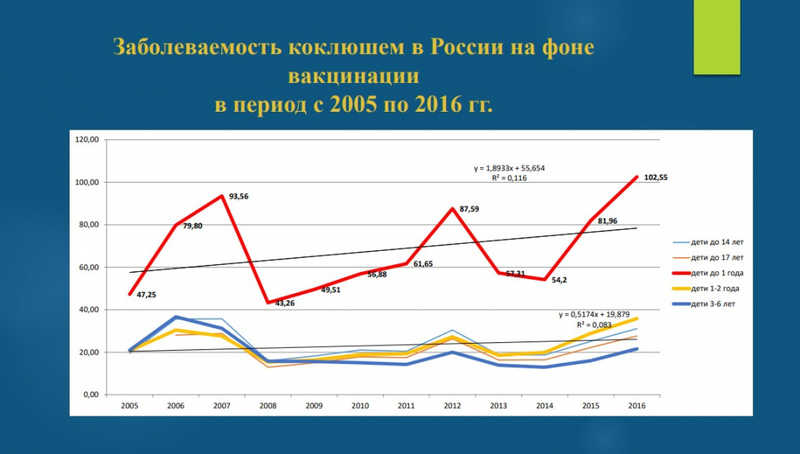
В чем причина? Скорее всего — в недостаточной эффективности бесклеточной вакцины. В результате применению вакцины произошел отбор мутантов возбудителя коклюша, способных ускользать от иммунного ответа. Мутации находятся в генах, белки которых входят в состав вакцины. Обе вакцины способны купировать болезнь, но не способны предотвратить размножение бактерии в организме человека и передачу другим людям.
В результате вакцинации значительно сократилась заболеваемость тяжелыми формами коклюша и смертность. Но в результате введения новой вакцины иммунитет стал короче, а его напряженность — ниже. Она приводит к формированию только гуморального иммунного ответа и практически не дает клеточного. Заболеваемость увеличивается в основном за счет стертой формы коклюша, наличием атипичных форм и бессимптомного носительства.
Возможные пути решения проблемы: молекулярно-генетический анализ циркулирующих штаммов B. pertussis, изучение серологического статуса населения, введение ревакцинации детей, подростков и взрослых в национальный календарь прививок, как это сделано в Москве. Для этих целей в настоящее время возможно использование только БКВ. А также разработка принципиально новых живых коклюшных вакцин, способных к формированию противобактерийного иммунитета и местного иммунитета слизистой.
Уже довольно давно была разработана рекомбинантная живая вакцина интраназального применения для профилактики коклюша (ГамЖВК). В состав входит генетически аттенуированная бактерия B. pertussis 4M.
На первом этапе клинических испытаний вакцины были подобраны дозы. На втором этапе была определена схема введения, способ введения, разработана чувствительная количественная тест-система ПЦР РВ для выявления ДНК бактерии.
Уже закончилась фаза 3 с участием взрослых добровольцев 18–65 лет. Была подтверждена безопасность, иммуногенность и противобактерийная защитная активность ГамЖВК. Был определен способ введения (капельно), схема введения для младенцев (двукратно), а также подростков и взрослых (однократно).
Докладчик подчеркнул необходимость разработки тест-системы ИФА для определения эффективности вакцинации и диагностики коклюша, а также методов и стандартных образцов для масштабирования производства и контроля качества ГамЖВК.
Вакцина индуцирует как гуморальный, так и клеточный иммунный ответ. Показана противобактерийная защитная активность ГамЖВК, проявляющаяся в более чем двукратном сокращении времени элиминации бактерий из носоглотки после повторной иммунизации добровольцев.
Показали безопасность и эффективность вакцины на младенцах павианов.
Приступили к процедуре регистрации препарата, пока для ревакцинации взрослых, в том числе с целью создания «семейного» иммунитета.
Надежда Кузнецова, к.б.н., ФГБУ «НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Минздрава России (Москва), выступила с докладом «Вакцины для профилактики клещевого энцефалита (КЭ): антигенный состав и сроки защиты».
Ежегодно в Росси регистрируются до 2000 случаев КЭ. За 2022 год в Москве было зарегистрировано 12 случаев. Переносчики в основном — клещи семейства Ixodidae.
Есть четыре основных генотипа: дальневосточный, европейский, сибирский и байкальский.
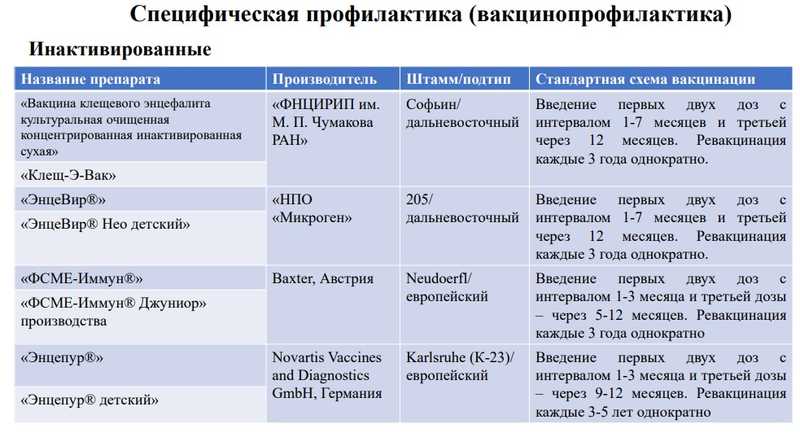
Специфических терапевтических схем не существует, основным способом профилактики является вакцинация. На территории России разрешены к использованию вакцины четырех производителей — ФНЦИРИП им. М.П. Чумакова РАН, НПО «Микроген», Baxter (Австрия) и Novartis (Германия).
Но есть проблема — низкая приверженность людей вакцинации, в том числе из-за сложной схемы. К тому же вакцинация не обеспечивает 100%-ную защиту. У привитых могут развиваться тяжелые формы с хроническим течением.
Так, более низкая протективная активность вакцины Энцепур (штамм K23) против вирусов дальневосточного и сибирского генотипов и даже против штамма Neudoerfl европейского подтипа обусловлена мутациями в области DI-DII белка E вакцинного штамма K23.
Все же у инактивированных вакцин есть преимущества: они чаще всего обеспечивают перекрестный иммунитет, вакцины взаимозаменяемы и относительно просты в производстве.
Но в то же время эти вакцины не обеспечивают 100%-ную защиту и требуют ревакцинации каждые три года.
Идеальная вакцина должна иметь высокую иммуногенность во всех возрастных группах и группах риска, индуцировать стойкий иммунитет без необходимости в повторной вакцинации, обеспечивать 100% защиту от всех подтипов ВКЭ, быть экономичной и безопасной.
Выбрали три подхода к созданию новых вакцин против вируса КЭ:
Первый — живые аттенуированные рекомбинантные вакцины на основе вакцинного штамма вируса желтой лихорадки, второй — на основе аденовирусных векторов, третий — мРНК-платформы.
С помощью подходов обратной генетики получили два варианта гибридной кандидатной вакцины против КЭ. Часть генов вируса желтой лихорадки заменены на гены вируса КЭ. На мышах проверили иммуногенность, протективность и безопасность вакцин. Эксперимент окончился неудачей, поскольку оказалось, что вирус нужно дополнительно аттенуировать, но при этом сохранить иммуногенность.
Также проверили вакцину на основе аденовирусного вектора и мРНК-вакцину. Оказалось, что у первой вакцины нейтрализующая активность сопоставима с инактивированной вакциной, а у мРНК вакцины титры вирус-нейтрализующих антител превышали инактивированную вакцину. Это приоритетный подход на настоящий момент.
Дарья Воронина, ФГБУ «НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Минздрава России (Москва), выступила с докладом «Наноантитела широкого спектра к глобулярному домену гемагглютинина как потенциальное средство для терапии сезонного гриппа А (H3N2)».
Есть сомнения в эффективности вакцин к сезонному гриппу A (H3N2): в среднем эффективность 33% при совпадении вакцинного и циркулирующего штаммов, 23% при несовпадении антигенов. Также при преобладании этого генотипа высока вероятность возникновения осложнений. Еще одна проблема — растущая резистентность вируса к противовирусным средствам в результате высокой изменчивости вируса.
Гемагглютинин — перспективная терапевтическая мишень. Наноантитела обладают определенными преимуществами, например, они взаимодействуют с труднодоступными эпитопами, что особенно актуально для вирусных антигенов. Они обладают высокой растворимостью, термостабильностью. Еще одно преимущество — относительная простота генно-инженерных манипуляций.
Верблюда иммунизировали рекомбинантным гемагглютинином подтипа H3. Селекцию проводили на вирусе H3N2. В результате было отобрано три клона, которые эффективно связывались с гемагглютинином H3 различных штаммов. Однодоменное антитело было слито с Fc-фрагменом человеческого IgG1. Такая модификация увеличивает время циркуляции, связывающую способность (за счет естественной димеризации Fc-фрагмента). Другие Fc-зависимые эффекторные функции: антитело-зависимая клеточная цитотоксичность, антитело-зависимый клеточный фагоцитоз, комплемент-зависимая цитотоксичность.
В результате модификации антигенсвязывающая способность увеличилась в несколько десятков раз. Некоторые антитела приобрели способность связывать больший спектр штаммов.
Два антитела обеспечивали 100%-ную защиту у мышей при интраназальном введении. Сфокусировались на одном антителе в профилактическом и терапевтическом режимах.
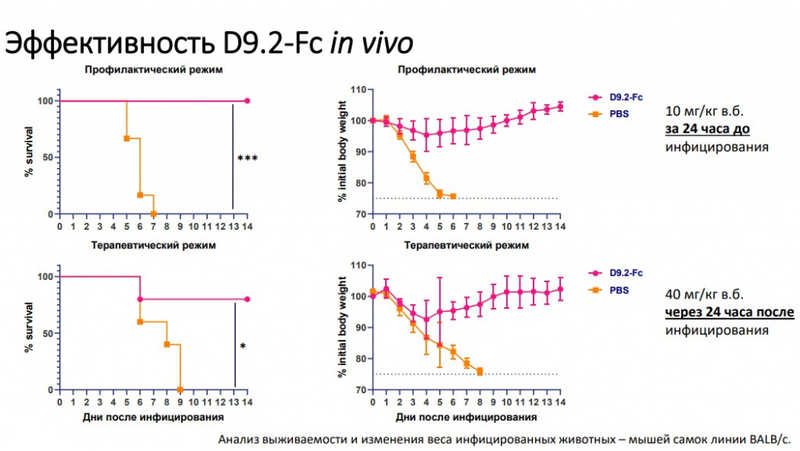
Антитело не способно блокировать проникновение вируса в клетку или ингибировать выход вируса из клетки. Однако количество и площадь бляшек уменьшаются, то есть антитело способно блокировать распространение вируса от клетки к клетке. На данный момент выясняется механизм защитного действия антитела.
Информация о докладчиках
Андрей Андреевич Почтовый, к.б.н., из ФГБУ «НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Минздрава России (Москва)
Елена Петровна Мазунина, ФГБУ «НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Минздрава России (Москва)
Екатерина Игоревна Рябова из ФГБУ «НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Минздрава России (Москва)
Геннадий Иванович Каратаев, д.б.н., из ФГБУ «НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Минздрава России (Москва)
Надежда Анатольевна Кузнецова, к.б.н., из ФГБУ «НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Минздрава России (Москва)
Дарья Владимировна Воронина из ФГБУ «НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Минздрава России (Москва)


 Меню
Меню





 Все темы
Все темы




 0
0