Механизм лекарственной устойчивости малярии исследован в деталях
Авторы статьи, опубликованной в Nature, получили структуру ключевого белка малярийного плазмодия, связанного с его устойчивостью к лекарствам, — транспортера PfCRT. Мутации, вызывающие замену аминокислотных остатков, обращенных в центральную полость PfCRT, позволяют резистентным паразитам транспортировать противомалярийные препараты из пищеварительной вакуоли.
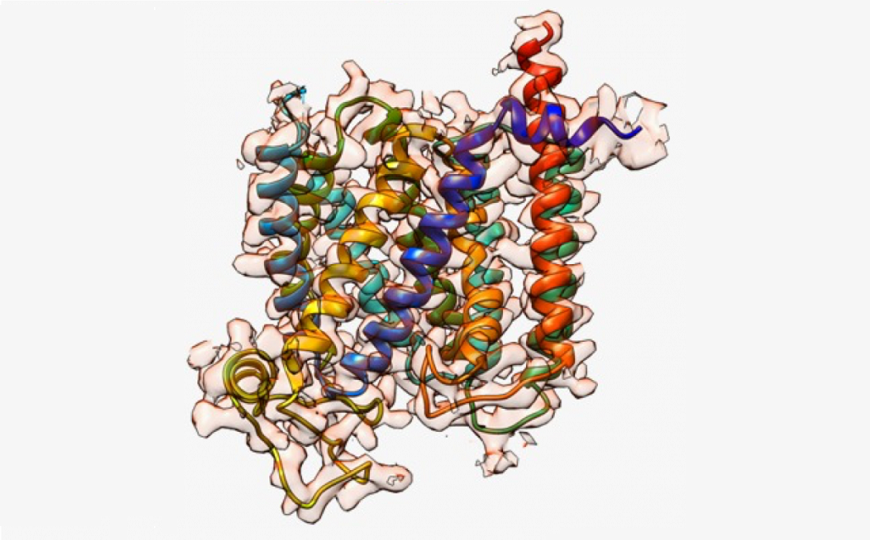
Транспортер PfCRT — ключ к лекарственной устойчивости плазмодия. Credit: | Пресс-релиз университета Колумбия
Около полумиллиона человек, большинство из которых — дети, живущие в Африке, ежегодно умирают от малярии. Борьба с малярией, особенно вызванной высоковирулентным простейшим паразитом Plasmodium falciparum, осложняется появлением устойчивости к противомалярийным препаратам.
Малярийные паразиты, проникшие в эритроциты человека, переваривают гемоглобин в пищеварительных вакуолях. При этом образуется свободный гем, токсичный для паразита. Хинолиновые препараты, например, хлорохин и пиперахин, взаимодействуют с гемом в пищеварительной вакуоли и мешают плазмодию его обезвредить — фактически, в присутствии хлорохина паразит отравляется продуктом собственной жизнедеятельности.
Доступность, безопасность и эффективность хлорохина сделали его основным противомалярийным препаратом, однако в 1980-х годах широко распространились резистентные линии плазмодия. Начали использовать родственное соединение — пиперахин, в настоящее время он применяется в сочетании с другим противомалярийным препаратом, дигидроартемизинином. (За получение артемизинина получила Нобелевскую премию по физиологии и медицине 2015 года китайская исследовательница Юю Ту.) Но затем стали появляться штаммы, устойчивые и к пиперахину, и к комбинированной терапии. Интересно, что появление устойчивости к пиперахину может сопровождаться повышением чувствительности к хлорохину.
Еще в 2000 году было установлено, что устойчивость достигается благодаря мутациям в белке-транспортере PfCRT, который находится в мембране пищеварительной вакуоли плазмодия. Резистентность возникала независимо в разных регионах мира, но всегда была связана с заменой аминокислотного остатка лизина треониновым (мутация K76T). Эта мутация сопровождалась другими, специфичными для регионов.
Для дальнейшей борьбы с резистентностью было важным детально исследовать структуру транспортера. Авторы новой статьи использовали одночастичную криоэлектронную микроскопию для изучений PfCRT южноамериканских паразитов линии 7G8, устойчивых к высоким концентрациям хлорохина. PfCRT с массой 49 килодальтон достаточно мал для криоЭМ, поэтому авторы исследовали его комплекс с антигенсвязывающим фрагментом (Fab) антитела, который имеет достаточно большую массу и стабильность. (С этим было связано ограничение исследования: из-за связывания с Fab транспортер был заблокирован в конформации, открытой в пищеварительную вакуоль.) Так или иначе, авторы впервые получили структуру PfCRT с разрешением 3,2 Å.
У PfCRT есть десять трансмембранных доменов и отрицательно заряженная центральная полость. Она достаточно велика, чтобы в него поместились молекулы хлорохина и пиперахина. Однако в трансмембранной полости PfCRT дикого типа находится положительно заряженный остаток лизина (K76); вероятно, он отталкивает хлорохин и пиперахин, несущие соответственно два и четыре положительных заряда.
Как отмечают авторы нового исследования, мутация K76T изменяет распределение заряда в полости PfCRT таким образом, что через нее проходит хлорохин, но не пиперахин. Другие мутации, например, C350R, позволяют транспортеру выводить из вакуоли и пиперахин, однако при этом становится менее эффективным транспорт хлорохина (см. рисунок).
Таким образом, паразиты с мутацией K76T устойчивы к хлорохину, но не к пиперахину, а дополнительные мутации, которые наблюдались у паразитов Южной Америки и Юго-Восточной Азии в последние пять лет, снижали чувствительность к пиперахину, но повышали к хлорохину. Авторы предполагают, что эти дополнительные мутации могут уменьшить отрицательный заряд или изменить конформацию центральной полости, что мешает пиперахину слишком прочно связываться с ней и улучшает его выведение.
Данные о структуре транспортера PfCRT особенно важны для понимания того, какие мутации устойчивости могут возникнуть в дальнейшем. Например, в Африке относительно мало резистентных к хлорохину плазмодиев, и комбинированная терапия по-прежнему эффективна, однако устойчивость может появиться в любой момент. «Существуют сотни участков в PfCRT, которые могут быть видоизменены, но теперь мы можем сказать: просто посмотрите на несколько этих в центральной полости, с определенными структурными и консервативными свойствами, — говорит один из руководителей исследования, Дэвид Фидок из университета Колумбия (США). — Они единственные, которые могут вызвать резистентность».
Источники
Kim, L. et al. // Structure and drug resistance of the Plasmodium falciparum transporter PfCRT. // Nature, 2019, doi: 10.1038/s41586-019-1795-x
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0







