Модифицированные основания и сахара снизили нейротоксичность антисмысловой терапии
Применение антисмысловых олигонуклеотидов (АСО) для лечения неврологических заболеваний ограничено из-за их нейротоксичности. Японские ученые предложили вводить в АСО модификации сахаров и оснований — замкнутые нуклеиновые кислоты и аналог цитозина. Это не только улучшило эффективность нокдауна генов, но и практически полностью избавило АСО от нейротоксичности.

Антисмысловые олигонуклеотиды (АСО) способны изменять экспрессию генов, влиять на сплайсинг мРНК или подавлять активность микроРНК. В последние годы все больше АСО проходит клинические исследования и переходит в практику, однако разработке АСО для лечения неврологических заболеваний препятствует нейротоксичность. Так, тоферсен — АСО, который снижает уровень тонких полипептидных нейрофиламентов в плазме крови, — может вызывать миелит, менингит и радикулопатия. Чтобы снизить нейротоксические эффекты АСО, японские ученые предложили ввести ряд модификаций в основания и сахара, входящие в их состав.
В работе ученые использовали гапмерные АСО. Их особенность заключается в том, что в основном такие АСО состоят из ДНК, но на их концах находится РНК, причем часто используются модифицированные рибонуклеотиды. Механизм работы гапмерных АСО зависит от действия РНКазы H, которая разрушает РНК в дуплексах ДНК—РНК. Кроме того, гапмерные АСО более устойчивы к нуклеазам. Исследователи предложили модифицировать сахара в АСО за счет замкнутых нуклеиновых кислот (LNA), когда в молекулу вводится «мостик», который соединяет 2'-кислород и 4'-углерод, таким образом «запирая» рибозу. Еще одна использованная в работе модификация сахара — это введение в рибозу 2'O-метоксильной группы (MOE). Обе модификации повышают устойчивость АСО к нуклеазам, а также увеличивают аффинность их связывания с целевой последовательностью. Наконец, исследователи использовали модифицированное основание — 9-(аминоэтокси)феноксазин (AEO), также известный в англоязычной литературе как G-clamp. Это основание — аналог цитозина, который может образовывать дополнительные водородные связи при взаимодействии с гуанином.
Ученые разработали панель АСО с разными модификациями против мРНК генов Malat1 и Mapt. В случае с мРНК Malat1 исследователи получили АСО из 20 нуклеотидов, которые либо не содержали никаких модификаций, либо содержали две LNA, либо два AEO, либо два нуклеотида и с LNA, и с AEO. При введении модификаций в АСО повышалась температура плавления, причем наибольшая наблюдалась при наличии и LNA, и AEO одновременно. Эффективность действия АСО авторы оценили in vitro, трансфицировав ими мышиные клетки нейробластомы Neuro-2a, измерив уровень экспрессии Malat1 и рассчитав IC50 (концентрацию полумаксимального ингибирования). Лучше всего с сайленсингом Malat1 справились АСО, содержащие два AEO или два нуклеотида с AEO и LNA. Аналогичные эксперименты ученые провели с АСО из 16 нуклеотидов против мРНК Mapt. Температура плавления тоже оказалась выше в АСО, включающих в себя либо AEO, либо и AEO, и LNA, с чем ученые и связали более высокую эффективность сайленсинга генов. Также, как и в экспериментах с Malat1, мРНК Mapt in vitro лучше всего подавляли АСО с двумя AEO либо с AEO и LNA.
Далее исследователи синтезировали еще ряд АСО с модификациями, направленных против мРНК Malat1. Так, они получили АСО с пятью и четырьмя MOE на 5' и 3' концах, а также АСО, которые помимо MOE содержали либо только LNA, либо только AEO, либо и LNA, и AEO. При этом наблюдалась та же тенденция с повышением температуры плавления у АСО, содержащих AEO. Все эти АСО показали одинаковую эффективность сайленсинга гена in vitro.
Действие модифицированных АСО оценивали после интрацеребровентрикулярного введения 50 мкг АСО мышам. Острую нейротоксичность определяли по поведению мышей в открытом поле. Самыми токсичными оказались АСО без модификаций или только с LNA: побочные эффекты сохранялись в течение 4 ч после введения, а в открытом поле такие мыши меньше и медленнее передвигались. Снизить нейротоксичность удалось за счет применения AEO, хотя у мышей, которым вводили АСО с AEO или с AEO и LNA, все равно замедлялось движение, а побочные эффекты сохранялись в течение 2 ч после введения препарата. Значительно менее токсичными оказались АСО с MOE, при этом у АСО, которые содержали MOE и либо только AEO, либо AEO и LNA, вообще не было нейротоксичности. Поведение таких мышей в открытом поле практически не отличалось от животных из контрольной группы, которым вводили фосфатно-солевой буфер.
Кроме того, действие модифицированных АСО оценили in vivo, используя для анализа разные области мозга мышей. АСО с AEO или с АЕО и LNA лучше, чем АСО без модификаций, справлялись с нокдауном Mapt в гиппокампе, затылочной и лобной долях мозга. Для них также была характерна сниженная нейротоксичность.
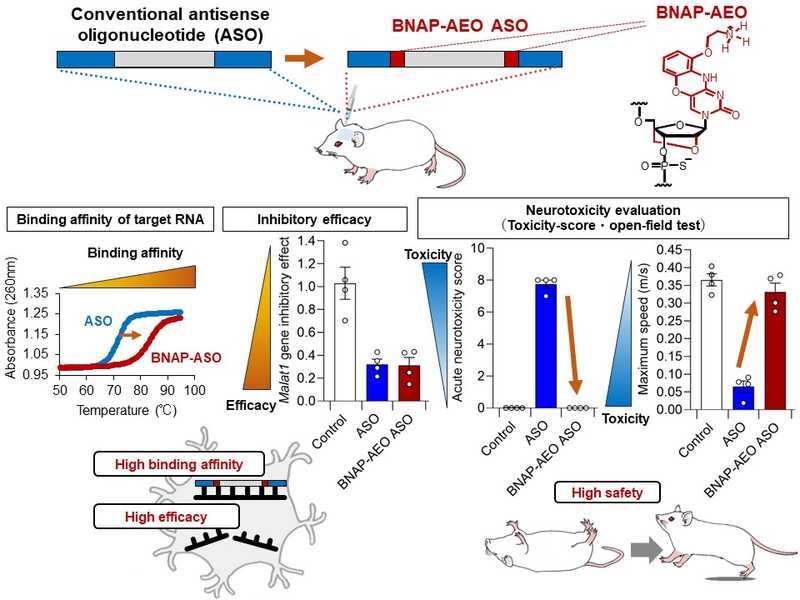 Модифицированные антисмысловые олигонуклеотиды (BNAP-AEO ASO) продемонстрировали более высокую аффинность к РНК-мишени, чем немодифицированные, и высокую ингибирующую активность при меньшей нейротоксичности. Credit: Nucleic Acids. 2024. DOI:
10.1016/j.omtn.2024.102161
Модифицированные антисмысловые олигонуклеотиды (BNAP-AEO ASO) продемонстрировали более высокую аффинность к РНК-мишени, чем немодифицированные, и высокую ингибирующую активность при меньшей нейротоксичности. Credit: Nucleic Acids. 2024. DOI:
10.1016/j.omtn.2024.102161
Считается, что нейротоксичность АСО связана с нарушением гомеостаза внутриклеточного кальция в нейронах. Он регулируется рецептором сигма-1. Исследователи предположили, что AEO снижает токсичность за счет взаимодействия с этим рецептором, так как структурно AEO похож на его лиганды. Чтобы проверить это, ученые сначала вводили мышам антагонисты рецептором сигма-1 и сигма-2, а затем — АСО. При этом нейротоксичность АСО с AEO значительно повышалась по сравнению с предыдущими экспериментами, что подтвердило гипотезу исследователей.


 Меню
Меню





 Все темы
Все темы




 0
0








