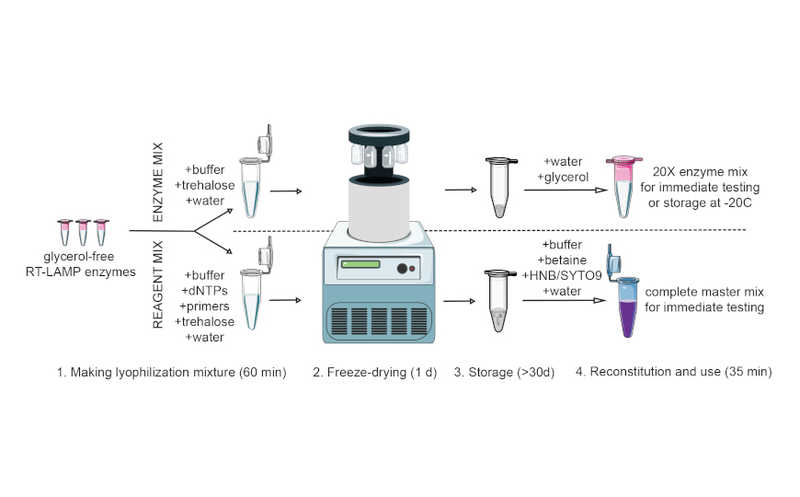
Модифицированный вирус таргетно доставил гены в мозг мышей
Доставка терапевтических генов в центральную нервную систему (ЦНС) — непростая, но важная задача, которая позволила бы расширить спектр поддающихся терапии генетических заболеваний. Авторы статьи в Science сконструировали для этой цели вирусный капсид, модифицировав аденоассоциированные вирусы. Такой вектор обладал тропизмом к ЦНС, проникал через гематоэнцефалический барьер и успешно доставлял целевые гены в мозг модельных мышей при внутривенном введении.
Разработка средств для эффективной доставки генов в центральную нервную систему (ЦНС) человека позволит расширить спектр поддающихся лечению генетических заболеваний. Для доставки генов часто применяют аденоассоциированные вирусные векторы (AAV), однако капсиды AAV с известными механизмами проникновения в ЦНС еще не описаны. Авторы статьи в Science зашли с другой стороны — они отобрали AAV по связыванию с человеческим рецептором трансферрина (TfR1) и показали, что один из них преодолевал гематоэнцефалический барьер (ГЭБ) и обеспечивал доставку генов в ЦНС.
Ученые выбрали в качестве мишени TfR1 из-за высокой экспрессии на ГЭБ человека, способности опосредовать конститутивный лиганднезависимый рецептор-опосредованный трансцитоз через сосуды ЦНС, а также способность усиливать доставку биопрепаратов в ЦНС мышей и приматов, включая человека.
Нацеливание капсидов аденоассоциированных векторов на TfR1 исследователи проверяли с помощью скрининга in vitro. Они получили библиотеки капсидов на основе серотипа AAV9, состоящие из вариантов со случайными вставками из семи аминокислот между остатками 588 и 589 белка VP1. По результатам скрининга авторы отобрали четыре наиболее перспективных варианта для дальнейшей проверки — BI-hTFR1, BI-hTFR1-2, BI-hTFR1-3 и BI-hTFR1-4. Дальнейший анализ связывания капсидов с TfR1 сподвиг исследователей выбрать первый из них для последующих экспериментов.
Затем авторы проверили, какой механизм лежит в основе усиления трансдукции эндотелиальных клеток мозга исследуемым вектором. Они трансдуцировали клеточную линию hCMEC/D3 в присутствии двух анти-TfR1 антител — OKT9 (нацелено на апикальный домен TfR1) и AF2474 (конкурирует с трансферрином за связывание с этим рецептором). Оказалось, что только OKT9 дозозависимо подавляло трансдукцию клеток BI-hTFR1. Это важное обнаружение, отмечают ученые, поскольку в противном случае присутствующий в организме трансферрин бы конкурировал с аденоассоциированным вирусом за связывание с TfR1 и снижал бы эффективность доставки гена в клетки. Такого воздействия они, однако, не обнаружили.
В трансвелл-модели гематоэнцефалического барьера ученые анализировали транспорт BI-hTFR1 через эндотелиальные клетки. Для сравнения они взяли AAV9 и AAV2, а измерения проводили при двух температурах — 37°C и 4°C. При низкой температуре АТФ-зависимый трансцитоз подавляется, и перенос вирусных частиц происходит за счет пассивного транспорта. В соответствии с предыдущими данными, AAV9 преодолевал барьер эффективнее, чем AAV2, причем по АТФ-зависимому механизму. Транспорт BI-hTFR1 при этом происходил намного активнее при 37°C, чем транспорт двух других AAV. Таким образом, BI-hTFR1 эффективнее переносится через ГЭБ, и это происходит путем АТФ-зависимого трансцитоза. Дальнейшее изучение подтвердило, что механизм заключался именно в рецептор-опосредованном трансцитозе.
Тропизм сконструированного аденовирусного капсида к ЦНС авторы также проверили in vivo. Они использовали трансгенных мышей, у которых экзоны Trfc, кодирующие его внеклеточный домен, были заменены на соответствующий участок человеческого гена. Таким мышам внутривенно вводили BI-hTFR1, кодирующий люциферазу и флуоресцентный белок. Через три недели после инъекции авторы наблюдали высокий уровень трансдукции в головном и спинном мозге трансгенных животных, но не животных дикого типа. Для AAV9, примененного в качестве контрольного вектора, разницы в биораспределении в зависимости от генотипа мыши не наблюдалось. При этом такое различие было характерно только для ЦНС, но не затрагивало другие органы — это подтвердило тропизм полученного вектора к ЦНС.
При этом сконструированный вектор успешно трансдуцировал нейроны и астроциты мышей с гуманизированным TfR1, но не мышей дикого типа, тогда как AAV9 справлялся с этим куда хуже. Так, после введения BI-hTFR1 у трансгенных мышей флуоресцировали в среднем 54, 32 и 68% NeuN+ нейронов в коре, стриатуме и таламусе, соответственно. У контрольных животных трансдукции подверглись менее 1% клеток. AAV9 трансдуцировал 1–6% NeuN+ клеток в тех же областях независимо от генотипа мышей. Также BI-hTFR1 трансдуцировал более 80% SOX9+ астроцитов в коре, стриатуме и таламусе трансгенных животных и до 10% — контрольных, тогда как AAV9 — около 20% в той и другой группе.
Наконец, исследователи убедились в том, что их вектор можно использовать для доставки терапевтических генов. Для доставки они выбрали ген глюкозилцерамидазы бета 1 (GBA1), снабженный гемагглютининовой меткой. Снижение активности этого фермента в мозге связано с прогрессией болезни Паркинсона, и ранние исследования показывали, что доставка GBA1 в мозг может лечить нейрональную α-синуклеинопатию.
Конструкты упаковывали в AAV9 или BI-hTFR1 и вводили внутривенно мышам с гуманизированным TfR1 в дозе 5 x 1012 или 1 x 1014 вирусных геномов/кг. Через три недели после введения препарата ученые обнаружили примерно в 30 раз больше вирусных геномов в мозге мышей, получавших BI-hTFR1 — как в низкой, так и в высокой дозе, — по сравнению с мышами, получавшими AAV9. Экспрессию целевого гена в ЦНС животных авторы подтвердили иммуноокрашиванием. Кроме того, в лизатах тканей и спинномозговой жидкости у мышей, получавших BI-hTFR1, наблюдалась повышенная активность глюкозилцерамидазы.
Исследователи применили уже изученный механизм — задействование апикального домена TfR1 — для переноса разработанного ими капсида через ГЭБ. Полученные результаты демонстрируют, что BI-hTFR1 может использовать рецептор-опосредованный трансцитоз для пересечения ГЭБ, чтобы доставлять гены в нейроны и глию по всей ЦНС. Авторы работы убеждены, что необходимо продолжить исследование их векторной конструкции как потенциального средства для генной терапии заболеваний ЦНС человека.
Анелловекторы — новая платформа для доставки генов в ткани человека
Источник
Qin Huang et al. An AAV capsid reprogrammed to bind human transferrin receptor mediates brain-wide gene delivery. // Science (2024). DOI: 10.1126/science.adm8386


 Меню
Меню





 Все темы
Все темы




 0
0