Можно ли вылечить старение
Секция «В авангарде науки: здоровое долголетие» на РКЛМ: при каком условии теломеразная активность продлевает жизнь мыши, а не убивает ее, что такое сенильные клетки, насколько сильно может отличаться биологический возраст от хронологического, как устроены «часы старения» и какие задачи решает исследование Russ-Age.

Мы продолжаем репортажи с Российского конгресса лабораторной медицины, который состоялся на прошлой неделе в рамках IV Российского диагностического саммита. Секция «В авангарде науки: здоровое долголетие» включала две большие лекции, одна о фундаментальных исследованиях старения, другая — о трансляции фундаментальной науки в медицину, а именно о биомаркерах старения и биологических часах.
О молекулярных механизмах старения рассказал Егор Евгеньевич Егоров (Институт молекулярной биологии им. В.А. Энгельгарта РАН, Московский физико-технический институт).
Нам сейчас странно это представить, но клетки млекопитающих в культуре долгое время считались бессмертными, способными проходить через неограниченное число делений. Еще в конце XIX века наблюдали неограниченный рост культивируемых опухолевых клеток. В лаборатории французского биолога и хирурга Алексиса Карреля (1973–1944) — неоднозначной личности, нобелевского лауреата и при этом сторонника евгенических идей — десятки лет выращивались клетки сердца куриного эмбриона (правда, не исключено, что в культуру попадали новые стволовые клетки о свежим экстрактом куриных эмбрионов). Только в 1961 году Леонард Хейфлик (1928–2024) опубликовал работу со странным «отрицательным результатом»: у него клетки росли не более полугода и переставали расти после определенного количества делений. «И у многих после этого перестали расти», — заметил докладчик.
Егор Евгеньевич напомнил, что это далеко не единственная заслуга Хейфлика. Он создал первый инвертированный микроскоп, который позволяет смотреть на культуру клеток снизу, в сосуде большого объема, а не на предметном стекле. Он впервые разработал порошковые среды для клеток. Он ввел в лабораторную практику линию диплоидных клеток человека (фибробластов из абортивного материала) WI-38; до того все работали на клетках мартышки, а также разработал метод культивирования микоплазм. Однако сегодня наиболее известен «предел Хейфлика» — понятие о конечном числе делений, через которые может пройти клетка.
Молекулярный механизм, объясняющий этот феномен, предложил в 1971 году А.М. Оловников (1936–2022). При копировании ДНК полимераза физически не может дойти до конца нуклеотидной цепочки, значит, при каждом удвоении ДНК должна укорачиваться; это явление она назвал маргинотомией («обрезанием полей»). Когда укорочение становится критическим, клетка перестает делиться. В клетках, преодолевающих предел Хейфлика, должен существовать механизм, который компенсирует это укорочение.
Первоначально статья Оловникова не привлекла должного внимания. Однако Элизабет Блэкберн и Кэрол Грейдер, в 2009 году получившие вместе с Джеком Шостаком Нобелевскую премию, в 1985 году открыли у инфузории тетрахимены фермент теломеразу. Этот фермент наращивает теломеры, добавляя к 3’-концу тандемный повтор TTAGGG и противодействуя укорачиванию. Интересно, что в 1988 году они узнали о статье Оловникова и решили выяснить, укорачиваются ли хромосомы в клетках человека со временем. Как известно, это предположение подтвердилось. Только в иммортальных клетках теломеры не укорачиваются благодаря активности теломеразы. Сам Оловников, как отметил Егор Евгеньевич, «подобно Грегору Менделю» в дальнейшем охладел к теломерной теории старения.
Концевую последовательность ДНК защищает шелтериновый комплекс, чтобы система репарации не распознавала конец хромосомы как разрыв. Шелтерин также препятствует формированию квадруплекса в концевом участке, богатом GGG-повторами, и позволяет образоваться теломерной петле. (С другой стороны, образование квадруплекса может быть использовано для подавления теломеразы: если такая структура есть, то теломераза не работает, и вещества, провоцирующие укладку концевого участка ДНК в квадруплекс, могут иметь противораковую активность.)
Докладчик рассказал о своей работе по введению гена каталитического компонента теломеразы (hTERT) в клетки, которые после этого преодолевали предел Хейфлика, сохраняя нормальную морфологию и кариотип. Возникло представление, что бессмертие уже у нас в руках, но скоро стало понятно, что путь к долголетию не может быть таким простым.
Очевидно, что нормальные теломеры — необходимое условие здоровья. Теломеропатии — гетерогенная группа заболеваний с общей причиной: дефектами теломер. Известны 15 генов, мутации в которых приводят к теломеропатиям. Вероятно, самая известная из них — наследственный дискератоз, редкое тяжелое заболевание, при котором развиваются поражения различных органов и тканей, от кожных аномалий и дистрофии ногтевых пластин до костной недостаточности, фиброзной трансформации печени и легких и лейкоза. Для этого заболевания характерна антиципация — утяжеление симптомов из поколения в поколение, так как у ребенка изначально теломеры короче, чем у родителя. Больному может потребоваться пересадка легких и печени. Варианты генной терапии пока испытываются на мышах.
При этом трансгенные мыши без теломеразы, которых получила испанская исследовательница Мария Бласко, были довольно здоровыми — болезненными и короткоживущими оказались только их праправнуки. Оказалось, у мышей очень длинные теломеры, так что критическое укорочение происходит нескоро.
У других мышей, полученных в лаборатории Марии Бласко, во всех клетках активно работала теломераза, и у них повысилась частота онкозаболеваний. Но затем ученые дополнили эту модификацию онкосупрессорами p53, p16 и p19ARF и получили линию мышей с улучшенным здоровьем, которые жили на 26% дольше контроля.
Более того, вектор на основе аденоассоциированного вируса, доставляющий ген теломеразы в организм взрослых и пожилых мышей, оказал благотворное влияние на их здоровье и физическую форму, включая чувствительность к инсулину и нервно-мышечную координацию. При этом частота онкозаболеваний у таких мышей не выросла.
Позднее, в 2019 году, Мария Бласко с коллегами получили аналогичный результат путем отбора половых клеток с самыми длинными теломерами. Мыши, выращенные из таких клеток, не только жили долго и не болели, но и были худыми. У них также было снижен уровень повреждений ДНК.
Известно, что скорость накопления мутаций отрицательно коррелирует с продолжительностью жизни, тем не менее значительная часть соматических мутаций не является фатальной для организма. Но о мутациях в теломерной области этого сказать нельзя. Неправильная укладка теломеры выглядит как повреждение ДНК, репарация укорачивает теломеру, и это приводит к катастрофическим последствиям.
Затем докладчик рассказал о сенильных (сенесцентных) клетках. Называть их «стареющими», как иногда делается в российских публикациях, не совсем правильно, скорее это клетки, имеющие нерешаемые проблемы, — с повреждениями, которые невозможно починить. Они не умирают, когда достигают предела Хейфлика, как считалось ранее, а перестают делиться. Фенотипически они весьма разнообразны, и все же у них есть нечто общее. Джудит Кампизи (1948–2024) с коллегами в 1995 году описала бета-галактозидазную активность как маркер сенесцентных клеток. Однако не все сенильные клетки экспрессируют бета-галактозидазу. Эти клетки характеризуются набором различных маркеров, однако среди них нет эксклюзивно связанных со старением. В 2022 году был создан консорциум SenNet, цель которого — выяснить, чем отличаются сенильные клетки от несенильных, и научиться на них воздействовать.
Позднее появилось понятие об ассоциированном с сенильностью секреторным фенотипом (SASP). Клетки пытаются сообщить о своих проблемах соседям, секретируя компоненты, нарушающие целостность ткани (например, металлопротеазы, которые портят внеклеточный матрикс), привлекают клетки иммунной системы, провоцируют воспаление. Углубление сенильности сопровождается эпигенетическими изменениями, которые позволяют активироваться ретротранспозонам в ядре клеток. Ретротранспозоны — это остатки вирусов, встроившихся в геном в процессе эволюции; они составляют значительную долю генома. Активация ретротранспозонов может восприниматься клетками как вирусная атака, что также увеличивает воспалительный фон. Клеточная сенильность заразна: соседи сенильных клеток сами могут стать сенильными.
В 2000 году появилась концепция inflammaging — воспалительного старения (о ней рассказывал Клаудио Франчески на МД-2023). Согласно этой концепции, старение человека сопряжено с постепенным развитием слабого стерильного воспаления, которое снижает функциональность всех тканей. «Благородные» функциональные клетки замещаются соединительной тканью, нарушаются кровоток и нервное сопровождение. Сенильными становятся и клетки иммунной системы.
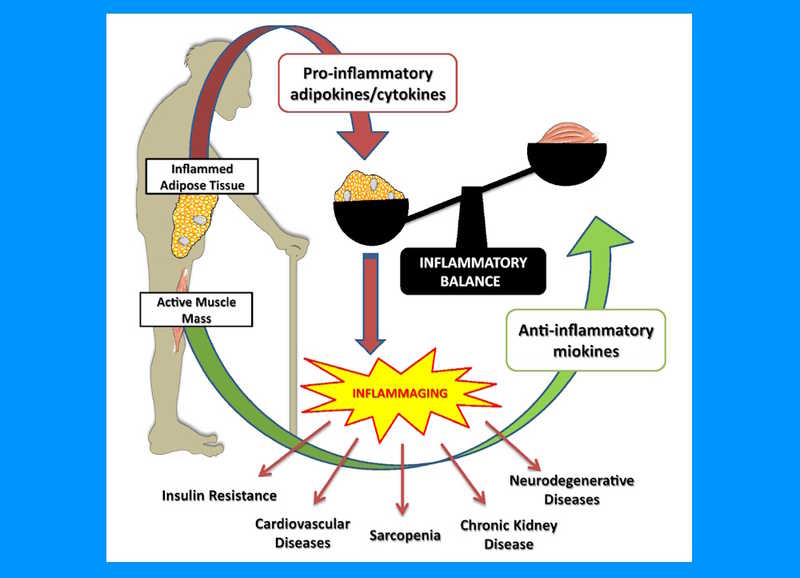 Физические упражнения противодействуют инфламмейджингу. (J. of Sci. in Sport and Exercise 1, 97–115 (2019). DOI: 10.1007/s42978-019-0015-6)
Физические упражнения противодействуют инфламмейджингу. (J. of Sci. in Sport and Exercise 1, 97–115 (2019). DOI: 10.1007/s42978-019-0015-6)
Развитию воспаления, связанного с возрастом, способствуют соматические мутации. Такие мутации в костном мозге увеличивают провоспалительную активность моноцитов. С повышенной частотой в старших возрастных группах встречается клональный гемаопоэз с неопределенным потенциалом (clonal hematopoiesis of indeterminate potential, CHIP), то есть появление генетически отличных популяций клеток крови из-за мутаций в стволовых клетках. CHIP обычно не вызывает выраженных симптомов, но повышает риск сердечно-сосудистых заболеваний, раков крови, ухудшает ответ на онкотерапию.
В последнее десятилетие активно исследуются сенолитики — вещества, избирательно уничтожающие сенильные клетки. На мышиных моделях сенолитики продемонстрировали чудесные свойства, снижая биологический возраст после однократного применения. В 2015 году вышло исследование о системном омоложивающем действии на мышей комбинации двух малых молекул — дазатиниба и кверцетина. Дазатиниб — ингибитор протеинкиназ, применяемый для терапии лейкозов, кверцетин известен противовоспалительным и антиоксидантным действием.
В 2019 году были опубликованы первые результаты клинического исследования дазатиниба и кверцетина на пациентах с идиопатическим легочным фиброзом, они все еще продолжаются. Но в целом применительно к человеку успехи не настолько блестащие.
Подавление SASP рассматривалось как универсальная стратегия борьбы с возрастными болезнями. Однако подходы, связанные с уничтожением сенильных клеток, имеют очевидное ограничение: пожилые люди и так страдают от саркопении и снижении функции нервных клеток, не усугубит ли ситуацию отправление в апоптоз сенильных, но все еще функциональных нервных или мышечных клеток?
В заключение докладчик рассказал об исследовании, которое вышло совсем недавно: повреждение обеих копий гена интерлейкина-11 (IL-11) у мышей увеличивает продолжительность жизни на 25%, что явно подтверждает концепцию инфламмэйджинга. У животных снизились уровни TNF, холестерина, триглицеридов и глюкозы в крови, увеличилось количество бурой жировой ткани и мускулатуры, а общая масса тела уменьшилась. Аналогичным образом действовали и антитела против IL-11 (подробнее в нашем недельном обзоре).
Возвращаясь к началу лекции – не следует забывать, что «столбовая дорога старения» начинается с укорочения теломер, которое приводит как к сенильности клеток, так и к другим опасным изменениям, включая геномную нестабильность и истощение пула стволовых клеток.

Доклад член-корр. РАН Ольги Ткачевой (Российский геронтологический научно-клинический центр РНИМУ им. Н. И. Пирогова Минздрава России) был посвящен практическим аспектам геронтологии, а именно биомаркерам старения.
Траектория развития маленького ребенка хорошо известна, любой педиатр скажет, в какие сроки человек должен научиться сидеть без поддержки, произносить слоги или брать предметы. Но сценарий старения у каждого свой, в нем нет единообразия. Биологический возраст может сильно отличаться от паспортного, и чем старше когорта, чем больше расходятся траектории старения.
Повышение возраста населения стало глобальной проблемой, подчеркнула Ольга Николаевна. За последнее время продолжительность жизни увеличилась на 30 лет, но далеко не всегда это годы здоровой жизни. «Серебряное цунами» — рост числа пожилых в популяции — вызвало эпидемию возраст-ассоциированных заболеваний и состояний, таких как фибрилляция предсердия, сердечная недостаточность, саркопения, деменции, сенсорные дефициты. При этом клинические исследования проводятся на «рафинированных» пациентах с единственной болезнью, в результате реальное большинство пациентов с множественными заболеваниями остается неисследованным.
Ольги Николаевна привела оценки экономического бремени старения. Расходы российского бюджета на пенсионное обеспечение в 2030 году, согласно прогнозам, достигнут 12% ВВП, к 2050 году — 16%. Общая численность экономически активного населения к 2030 году может сократиться на 9%, до 66,1 млн человек. И во всем мире лечение возраст-ассоциированных заболеваний составляет 50% от общего бремени заболеваний.
Старение является средой для развития всех возраст-ассоциированных заболеваний. Поэтому воздействие на старение — это воздействие на общую «причину причин» множества болезней, и отсроченное старение, увеличивающее количество здоровых пожилых людей, оказало бы значительный экономический эффект. Медицина должна перейти от лечения заболеваний по мере возникновения к их профилактике и затем к управлению старением, чтобы продлевать не только жизнь, но и здоровье.
Ольга Николаевна перечислила основные направления, по которым идет трансляция фундаментальных исследований старения в клиническую практику. Изучение фундаментальных механизмов старения и долголетия указывает на мишени для терапии. Геропротективные технологии помогают разрабатывать вмешательства, продлевающие жизнь. И, наконец, поиск биомаркёров старения и моделирование биологического возраста дают возможность применять калькуляторы биологического возраста в исследовательской и клинической практике.
Раньше врачей не интересовала скорость старения; предполагалось, что все люди стареют примерно одинаково, и паспортный возраст — все, что надо знать, чтобы оценить риски. Но теперь известно, что биологический возраст может очень сильно не совпадать с паспортным. Так, биологический возраст 38-летних варьирует от 28 до 61 года, как показало исследование Dunedin Study. В этом исследовании возраст 954 человек оценивали по 18 биомаркерам, и более высокие значения этого параметра коррелировали с худшим здоровьем, более низкими физическими и когнитивными способностями.
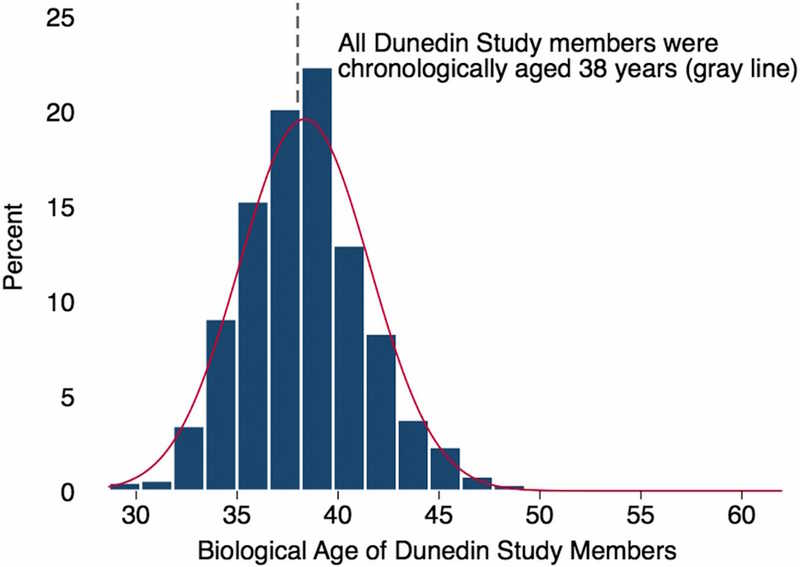
Биомаркеры старения нужны и для того, чтобы исследования процессов старения и геропротекторных вмешательств не требовали наблюдений, по продолжительности сравнимых с человеческой жизнью. Нужен способ, позволяющий быстро оценить, дает эффект то или иное вмешательство или нет. С другой стороны, геропротекторы с подтвержденной эффективностью могут использоваться для контроля новых биомаркеров старения. (На сегодня известно более 300 молекул с потенциалом геропротекции, хотя рандомизированных клинических исследований еще не было.)
Единой общепринятой классификации биомаркеров возраста пока не существует, но среди них можно выделить молекулярные (отдельные молекулы, такие как интерлейкин 6, и омиксные — липидомные, протеомные, метоболомные, эпигеномные), функциональные, физические и физиологические, радиографические (данные нейровизуализации), цифровые (данные с носимых устройств).
Хронология изучения биомаркеров возраста приведена в программной статье, опубликованной в Cell, среди авторов которой Вадим Гладышев, Витторио Себастиано, Майкл Снайдер, Стив Хорват, Алекс Жаворонков и др. Первые представления об изменяемости возраста появились еще в 1935 году, первые тесты для оценки биологического возраста человека — в 1969-м. Началом современной эпохи можно считать 2011 год — появление первых эпигенетических часов Стива Хорвата.
Эта же статья выделяет пять категорий биомаркеров старения: предсказательные (позволяют оценить выгоду для индивида от превентивного вмешательства), прогностические (оценивают риски заболеваний), ответные (оценивают реакцию на стресс или терапию), суррогатные (говорящие о состоянии индивида, например, артериальное давление) и исследовательские (связанные с молекулярными механизмами старения).
Мультиомиксные исследования выявляют удивительные закономерности — например, нелинейность старения, существование критических периодов, когда скорость неблагоприятных изменений резко возрастает, около 44 и около 60 лет. (Подробнее на PCR.NEWS.)
Калькулятор биологического возраста, или «часы старения» — это математическая модель с машинным обучением, которая определяет биологический возраст на основе набора биомаркеров, иногда весьма обширного. Они могут использовать различные типы данных: генетические, эпигенетические, транскриптомные, микробиотические, фенотипические, когнитивные, протеомные, липидомные, метаболомные. Примечательно, что искусственный интеллект способен отличить возрастные изменения от тех, что вызваны болезнью.
«Золотым стандартом» считаются эпигенетические часы Стива Хорвата — они наиболее точны, ошибка в пределах 2,7 года. Воспалительные часы старения, о которых рассказывал в Москве в прошлом году Клаудио Франчески и его коллеги из Нижнего Новгорода, высокой точностью не отличаются, как и микробиомные часы. Но они показывают изменения, которые важны для оценки потенциальных геропротекторов. Эпигенетические часы Морган Левин из Медицинской школы Йельского университета PhenoAge дают более точный прогноз по сердечно-сосудистым заболеваниям, чем существующие клинические шкалы. Калькулятор GrimAge, разработанный Аке Цу-Хуэй- Лю из Университета Калифорнии в Лос-Анджелесе, помимо метилома учитывает уровни 88 белков плазмы и индекс курения и с высокой точностью прогнозирует время до смерти, ишемической болезни сердца или онкозаболевания.
Выяснилось, что органы и системы человека стареют с разными скоростями, одни быстрее, другие медленнее: у кого-то слабым местом оказывается иммунная система, у кого-то метаболизм или нервная система. Поэтому сейчас разрабатывают калькуляторы биологического возраста для разных органов и систем. Трендом стали комбинированные тканеспецифические часы старения, объединения нескольких калькуляторов.
Докладчица рассказала про калькулятор, который разработали они с коллегами из МГУ, ИМБ РАН и других научных центров. В нем учитывается жесткость стенок сосудов (артериальный индекс). Преимущества этого теста в том, что он неинвазивен, не требует специализированного оборудования и значительных финансовых затрат.
Эпигенетические тесты отличаются высокой точностью, но исследование стоит дорого. Кроме того, они должны быть адаптированы к популяции: на метилом влияют разнообразные факторы образа жизни, и часы, обученные на данных из одного региона, необязательно будут так же хорошо работать в другом. Для российской популяции необходимо провести соответствующие исследования, чтобы методы определения биологического возраста адекватно работали
Среди задач клинического исследования Russ-Age, которое стартовало в 2022 году, — изучение динамики биомаркеров старения, феномена долгожительства, факторов успешного и неуспешного старения. В нем участвуют 3500 человек от 18 до 100 и более лет (в базе есть «молодые столетние» — до 110 и «пожилые» —110+). У них в том числе будут исследованы уровни более 100 биомаркеров старения и разработан калькулятор биологического возраста именно для российской популяции.
Russ-Age можно сравнить с Балтиморским исследованием, начатым в 1958 году или с MarkAge в Евросоюзе, стартовавшем относительно недавно — в 2015-м. У каждого из них есть свои недостатки и преимущества, но в любом случае такие исследования необходимы для лучшего понимания феномена старения. Если современная медицина рассматривает его как нормальный физиологический процесс, то медицина будущего включает профилактику и лечение старения, его замедление.
В завершение лекции Ольга Николаевна пригласила слушателей на конгресс «Управление старением» Российской ассоциации геронтологов и гериатров, который состоится в Москве 19-20 декабря.
Информация о докладчиках
Егоров Егор Евгеньевич, д.б.н., профессор, ведущий научный сотрудник, Институт молекулярной биологии им. В.А. Энгельгарта РАН, Москва
Ткачева Ольга Николаевна, д.м.н., профессор, член-корр. РАН, директор Российского геронтологического научно-клинического центра ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России, главный внештатный специалист-гериатр Минздрава России, президент ООО «Российская ассоциация геронтологов и гериатров», Москва


 Меню
Меню





 Все темы
Все темы
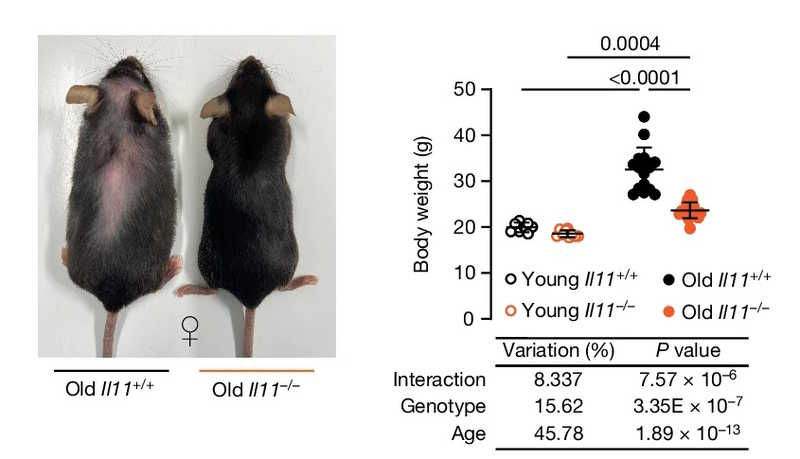 Nature (2024) DOI:
Nature (2024) DOI: 



 0
0