Некоторые клетки спинного мозга готовы к реорганизации нейронных цепей еще до возможной травмы
Ученые из Лозанны (Швейцария) подробно картировали клеточную и молекулярную динамику травмы спинного мозга в рамках открытого проекта Tabulae Paralytica. Они обнаружили небольшую субпопуляцию нейронов, устойчивых к повреждению, — в этих клетках в ответ на травму активировалась экспрессия генов, связанных с реорганизацией нейронных цепей. Исследователи предложили модель, согласно которой в спинном мозге присутствуют клетки, «подготовленные» к возможному повреждению на транскриптомном уровне.
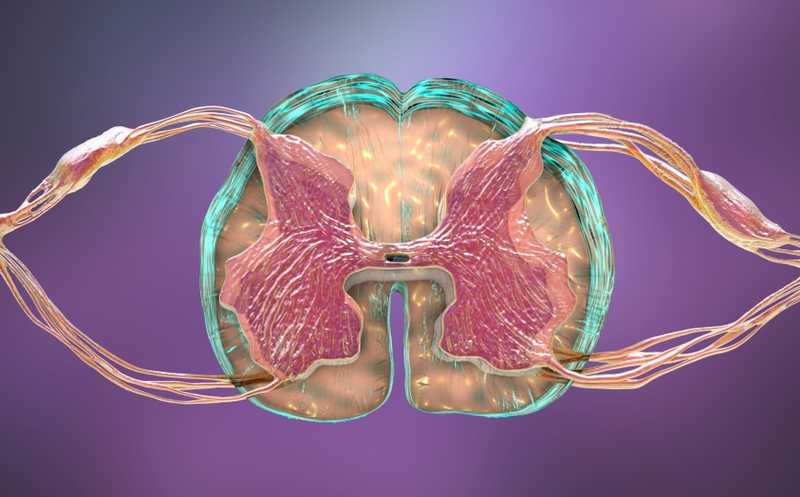
Травма спинного мозга (ТСМ) способна необратимо повреждать нервные ткани, приводя к потере неврологических функций. Развитие нейротехнологий и подходов к терапии значительно улучшило выживаемость пациентов и позволило купировать многие последствия неврологической дисфункции после такой травмы. Однако десятилетия исследований и крупномасштабные клинические испытания все еще не привели к созданию безопасных и эффективных методов восстановления поврежденного спинного мозга.
ТСМ вызывает каскад молекулярных и клеточных реакций, включающих инфильтрацию воспалительных клеток и высвобождение цитокинов, апоптоз, демиелинизацию, эксайтотоксичность, ишемию и формирование фибротического рубца, окруженного барьером из астроцитов. Восстановление повреждений спинного мозга требует глубокого понимания того, как нервные клетки и клетки глии координируют ответ на ТСМ.
До сих пор традиционные методы визуализации и картирования предлагали обобщенное представление о клеточных механизмах ТСМ. Но роль отдельных типов клеток была неизвестна. Ученые из Федеральной политехнической школы Лозанны (L'École polytechnique fédérale de Lausanne), используя данные транскриптомики и мультиомики, создали атлас травм спинного мозга, или Tabulae Paralytica. Атлас включает 482 825 отдельных клеток, охватывающих 18 экспериментальных условий и 71 499 пространственных баркодов, нанесенных на трехмерную архитектуру поврежденного спинного мозга. Для него доступно интерактивное веб-приложение.
Исследователи провели секвенирование РНК единичных ядер (snRNA-seq) для тканей травмированного спинного мозга в широком наборе экспериментальных условий и моделей травм. Они изучили влияние механических повреждений, пола, возраста и различных фармакологических воздействий на молекулярные каскады в клетках после повреждения. Опыты проводились на мышах. Анализ иммунного ответа в течение двух месяцев после повреждения выявил массовую инфильтрацию иммунных клеток на 7–14 день, при этом доля хемотаксически-индуцированных и воспалительных макрофагов возрастала с увеличением тяжести повреждения. Интересно, что доля протоплазматических астроцитов постепенно снижалась в течение первых нескольких дней после травмы, тогда как доля реактивных астроцитов увеличивалась сразу после травмы и сохранялась до хронической стадии. Эти результаты указывают на важную роль астроцитов в восстановлении после повреждения.
Цереброваскулярная система состоит включает артерии, артериолы, капилляры, венулы и вены, которые образуют физиологический барьер между кровеносной системой и спинным мозгом (гематоспинальный барьер). Он отделяет иммуноизолированную паренхиму спинного мозга от внеклеточной среды. Секвенирование РНК единичных ядер выявило сокращение эндотелиального и перицитарного компартментов и одновременное увеличение доли сосудистых лептоменингеальных клеток (VLMC) сразу после травмы. К 7-му дню ученые наблюдали увеличение доли барьерных клеток арахноидальной оболочки, известных своей ролью в формировании барьера спинномозговой жидкости (СМЖ), и снижение экспрессии генов, связанных с дисфункцией ГЭБ — это указывало на адаптацию гематоспинального барьера к повреждению.
Затем ученые исследовали вовлечение различных групп нейронов в восстановление после травмы спинного мозга. Ожидаемо, количество нейронов уменьшалось в зависимости от тяжести повреждения, подтверждая уязвимость нейронов спинного мозга. Исключением были нейроны, контактирующие со спинномозговой жидкостью (CSF-contacting neurons), которые проявили уникальную устойчивость к ТСМ. Анализ дифференциальной экспрессии показал активацию генов, связанных с клеточной адгезией (Cntnap5c), ангиогенезом (Rhoj) и острой фазой ремоделирования тканей (Timp3). Другие нейронные субпопуляции проявили равную уязвимость к ТСМ, указывая на активацию общих транскрипционных программ ответа на повреждение в начале и дальнейшее расхождение генных сигнатур. Так, нейроны, экспрессирующие как Vsx2, так и Nfib (местные Vsx2ON нейроны), показали наибольшую активацию генов, связанных с реорганизацией нейронных цепей, и ученые связали это с регенерацией после травмы. Это предположение подтвердилось тем, что удаление Vsx2ON нейронов нарушало естественное восстановление моторики и способности ходить после травмы умеренной тяжести.
Анализ половых различий в ответе на ТСМ у мышей не выявил значительных различий в транскрипционных программах между самками и самцами. Однако ученые обнаружили значительные транскрипционные различия между старыми и молодыми мышами. Анатомические исследования подтвердили, что у старых мышей более выраженно нарушался барьер между кровью и спинным мозгом, что сопровождалось увеличенной инвазией периферических иммунных клеток и в конечном счете приводило к более крупным повреждениям по сравнению с молодыми особями.
На основе этих наблюдений ученые предложили модель, согласно которой все нейроны проходят глубокий и в целом консервативный транскрипционный ответ сразу после травмы, который совпадает с дихотомическим исходом выживания или гибели клеток. В течение следующих недель выжившие нейроны демонстрируют постепенно расходящиеся транскрипционные реакции на повреждение, причем только в определенных субпопуляциях активируются гены, связанные с реорганизацией нейронных цепей. Степень этой индукции, вызванной повреждением, определяется исходным транскрипционным состоянием каждой нейронной субпопуляции — это предполагает, что определенные субпопуляции изначально подготовлены к активации генов, ответственных за восстановление.
Tabulae Paralytica — значительное достижение в исследовании повреждений спинного мозга. Новый атлас позволяет проследить изменение транскрипционных программ в отдельных клетках и применить полученные знания для разработки подходов к лечению травм спинного мозга. Хотя исследование проводилось на моделях грызунов, эти данные могут найти обширное применение в клинической практике в будущем.
Поврежденный спинной мозг можно восстановить с помощью неонатального внеклеточного матрикса
Источник
Skinnider, M.A., et al. Single-cell and spatial atlases of spinal cord injury in the Tabulae Paralytica. // Nature (2024). DOI: 10.1038/s41586-024-07504-y


 Меню
Меню





 Все темы
Все темы



 0
0