NICER — новый метод CRISPR-редактирования
Японские исследователи предложили технологию CRISPR-редактирования гетерозиготных мутаций, при котором донором последовательности для репарации служит аллель без мутации, находящийся в другой хромосоме, а в участок-мишень вносятся множественные ники — разрывы в одной из двух цепей ДНК. Эта технология реже приводит к нецелевым изменениям в геноме, чем CRISPR-Cas-редактирование, основанное на двухцепочечных разрывах.
S. Nakada | Пресс-релиз
Терапевтическое применение CRISPR-Cas осложняется нецелевым редактированием — ошибочным разрезанием других сайтов, кроме мишени, а также использованием путей репарации, оставляющим ошибки, — это негомологичное соединение концов (NHEJ) и соединение концов, опосредованное микрогомологией (MMEJ). При такой репарации вместо желаемой последовательности могут возникнуть не только небольшие инсерции и делеции (инделы), но и протяженные делеции, и даже обширные нарушения структуры хромосом. Поэтому продолжается разработка методов редактирования, более защищенных от ошибок.
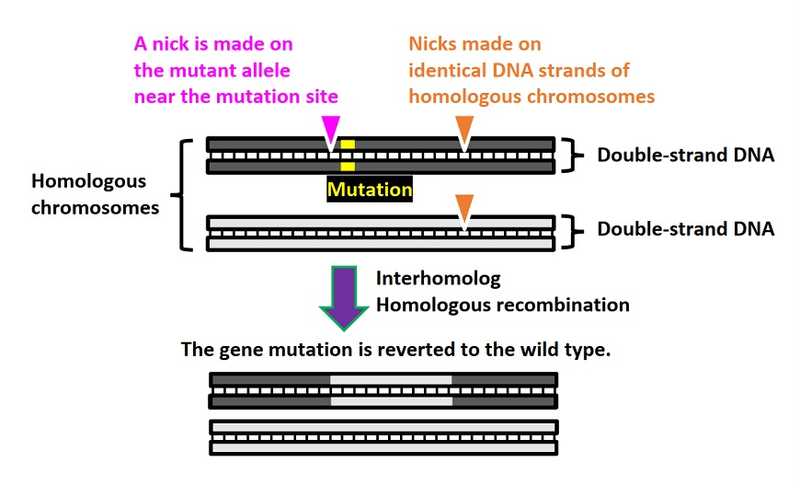
Исследователи из Университета Осаки и других научных центров Японии предложили метод исправления гетерозиготных мутаций в клетке. Когда один аллель ассоциирован с болезнью, а другой нормальный (дикого типа), в качестве матрицы для редактирования первого можно использовать второй. Редактирование запускает никаза Cas9D10A — вариант нуклеазы Cas9, который вместо двухцепочечных разрезов делает ники — разрезы в одной из двух цепей ДНК.
Никаза представляются привлекательным инструментом целевой репарации, минимизирующим нецелевые эффекты. Внесение ников в ДНК инициирует процессы исправления дефекта за счет соответствующей последовательности в гомологичной хромосоме. При этом может происходить рекомбинация, то есть обмен участками хромосом (этот путь тоже может смягчить симптомы заболевания, если две аллели с двумя разными мутациями преобразуются в один аллель дикого типа и один с двумя мутациями) или же репарация.
Ранее было показано, что внесение множественных ников в ген-мишень и в плазмиду, выполняющую роль матрицы для репарации, усиливает эффективность гомологичной рекомбинации по сравнению с единственным ником в последовательности-мишени. Авторы нового исследования предложили аналогичную стратегию, в которой матрицей для исправления мутации становится гомологичная хромосома с геном дикого типа. Они показали, что внесение множественных ников в обе хромосомы (включая один аллель-специфический ник в сайте мутации) позволяет исправлять гетерозиготные мутации в соматических клетках. Метод назвали NICER (multiple nicks induced by Cas9 nickase and a homologous chromosome as an endogenous repair template).
Для эксперимента взяли линию человеческих лимфобластных клеток TK6261, в которых оба аллеля гена тимидинкиназы 1 имели мутации (но в разных сайтах). Тимидинкиназа 1 (TK1) отвечает за биосинтез тимидинфосфата, ее активность можно отслеживать по способности клетки к пролиферации. Функция гена могла восстановиться тремя путями: за счет репарации по гомологичной хромосоме, обмена участками хромосом или делеции, восстанавливающей рамку считывания.
Авторы вводили в клетки с помощью электропорации мРНК никазы Cas9D10A и гидовых РНК. Сначала использовали только специфически нацеленную на мутацию-мишень гидовую РНК (первичную), затем две гидовых РНК — первичную и нацеленную на близлежащий участок (вторичную). Во втором варианте количество TK1-положительных клеток выросло в 17 раз; секвенирование подтвердило присутствие в этих клетках присутствие гена дикого типа.
Затем авторы создали 67 дополнительных гидовых РНК, нацеленных на участок ±8.6 т.п.н. вокруг мутации-мишени и проверили каждую из них на способность повышать эффективность редактирования. Шесть лучших продуцировали положительные по активности TK1 клетки с эффективностью 3–4%. Комбинация двух из этих шести с первичной гидовой РНК позволила достигнуть эффективности 5–6%. Также авторы показали, что разрывы могут делаться как в смысловой, так и в антисмысловой нити. Важный момент: технология была эффективна, когда разрывы, инициированные вторичными гидовыми РНК, происходили в обоих аллелях. (Вторичные гидовые РНК, в отличие от первичной, распознают не только хромосому-реципиент с мутацией, но и матрицу, см. рисунок.)
Для дальнейших экспериментов брали клетки людей, имеющих комплексные гетерозиготные заболевания. Например, фибробласты кожи пациента с апластической анемией, умственной отсталостью и синдромом карликовости, содержали гетерозиготные мутации в гене алкогольдегидрогеназы 5 (ADH5) и гене альдегиддегидрогеназы 2; экспрессию ADH5 удалось восстановить с помощью NICER.
Также авторы убедились, что их метод может исправлять не только инделы и миссенс-мутации, но и обширные делеции размером до 600 пар нуклеотидов. Нецелевое редактирование было редким.
Интересно установить, какие клеточные механизмы задействованы в репарации множественных ников. Гомологичная репарация двухцепочечных разрывов обычно происходит на поздних фазах S и G2 клеточного цикла (синтез и рост), репарация ников — по-видимому, даже в фазе G1 (подготовка к митозу). Образование ников приводит к обнажению одноцепочечной ДНК на обширном участке вокруг целевого сайта; эффективность процесса снижают нокдауны BRCA1 или BRCA2, нокаут EXO1; для редактирования необходим RAD51 (белок, играющий ключевую роль в рекомбинационной репарации). Однако детали процесса пока остаются неясными.
Результаты редактирования генов эмбриона нужно точнее контролировать
Источник
Tomita, A., et al. Inducing multiple nicks promotes interhomolog homologous recombination to correct heterozygous mutations in somatic cells // Nature Communications. 14, 5607 (2023). DOI: 10.1038/s41467-023-41048-5


 Меню
Меню





 Все темы
Все темы




 0
0








