Результаты редактирования генов эмбриона нужно точнее контролировать
Чтобы проверить, насколько успешно отредактирован ген эмбриона, обычно берут одну или несколько клеток на ранней стадии развития, амплифицируют и секвенируют их геном. Новое исследование Шухрата Миталипова с коллегами показало, что такой подход не дает полного представления о потере гетерозиготности вокруг мишени, которая способна привести к фенотипическому проявлению опасных рецессивных генов.
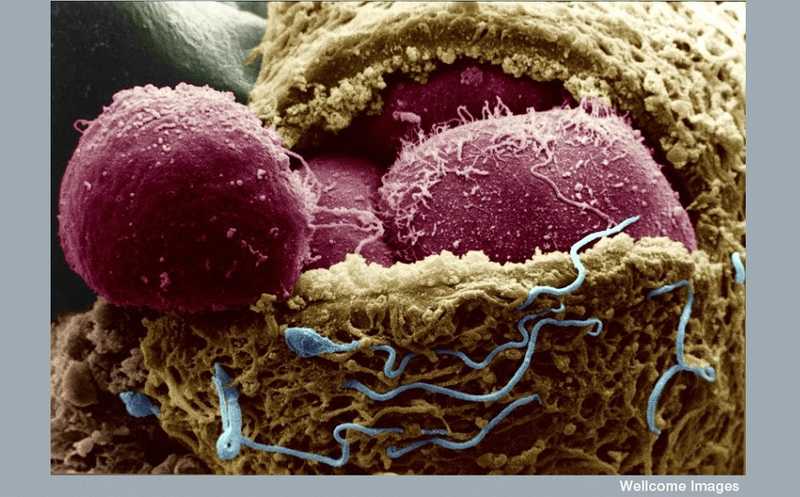
Сканирующая электронная микрофотография человеческого эмбриона на 4-й день. Оболочка, окружающая яйцо (zona pellucida, желтый цвет), надрезана и открывает эмбриональные клетки (бластомеры). Снаружи все еще видны многочисленные сперматозоиды (синий) |
Credit:
CC BY-NC-ND 2.0 | Yorgos Nikas, Wellcome Images | flickr.com
Ученые из Орегонского университета здравоохранения и науки (OHSU) под руководством Шухрата Миталипова и Паулы Амато вместе с коллегами из Китая и Южной Кореи показали, что секвенирование ДНК отдельных клеток не дает полной информации о результатах редактирования генов в ранних человеческих эмбрионах. Статья опубликована в Nature Communications. (Интервью с Шухратом Миталиповым о проблемах безопасности, с которыми столкнется человечество при редактировании клеток зародышевой линии, на PCR.NEWS.)
При редактировании могут возникнуть различные проблемы. Например, недостаточно быстрая работа CRISPR-Cas9 может привести к мозаичности — одни клетки эмбриона будут содержать исправления, другие нет. Возможно также нецелевое редактирование, ошибки, связанные с механизмом репарации NHEJ. Но есть и другие проблемы, которые не могут быть выявлены стандартными методами секвенирования.
«Это говорит о том, как мало мы знаем о редактировании генома и, в частности, о том, как клетки реагируют на повреждение ДНК, которое вызывает CRISPR», — говорит Шухрат Миталипов, директор Центра эмбриональной клеточной и генной терапии OHSU. — Репарация генов имеет большой потенциал, но эти новые результаты показывают, что нам предстоит еще много работы».
Для анализа генома ранних человеческих эмбрионов берут всего несколько клеток или даже одну, а затем проводят полногеномную амплификацию. Аналогичную процедуру — преимплантационное генетическое тестирование (ПГТ) — выполняют при скрининге эмбрионов, полученных с помощью ЭКО, чтобы отобрать для пересадки те, в геномах которых нет опасных мутаций. Однако методы подготовки к секвенированию, включающие амплификацию, имеют недостатки — различные участки генома могут быть неравномерно представлены в готовой библиотеке, возможна потеря аллельных вариантов. (Подробнее о подготовке библиотек для NGS на PCR.NEWS.)
«Тревожит то, что мы можем неправильно диагностировать эмбрионы», — говорит Паула Амато, профессор акушерства и гинекологии Медицинской школы OHSU.
Насколько часто теряются аллели при анализе клеток эмбриона? Чтобы ответить на этот вопрос, авторы секвенировали геном фибробластов женщины, сравнили его с геномами ее родителей и определили гетерозиготные аллели. Затем получили эмбриональные клетки, используя ядра этих фибробластов, и секвенировали ДНК отдельных бластомеров эмбрионов. Оказалось, что при секвенировании с амплификацией примерно 26,6% гетерозиготных локусов в контрольном бластомере «выглядят» гомозиготными.
Чтобы надежно исследовать результаты редактирования, авторы получили из эмбрионов с отредактированными генами линии эмбриональных стволовых клеток, которые растут в культуре и обеспечивают достаточно генетического материала для анализа ДНК без амплификации генома. ДНК выделяли из значительного количества клеток и не использовали полногеномную амплификацию (амплифицировали только таргетный участок, затем проводили секвенирование.)
Почему так важен вопрос о гомозиготных и гетерозиготных аллелях в отредактированном эмбрионе?
Эта новая работа в лаборатории Миталипова продолжает их предыдущие исследования нецелевого редактирования и репарации генов, которая следует за CRISPR-разрезом целевого участка (см., например, публикацию в Nature 2017 года). Мутация в гене белка MYBPC3 в гетерозиготном состоянии может вызывать гипертрофическую кардиомиопатию. Чтобы у больного мужчины с такой мутацией мог родиться здоровый ребенок, используют ЭКО; Миталипов с коллегами проверили, возможно ли повысить число эмбрионов, подходящих для трансплантации, с помощью CRISPR-редактирования, и получили обнадеживающие результаты. В яйцеклетку вводили сперматозоид и одновременно Cas9 с гидРНК (это делало редактирование более быстрым). Интересно, что для гомологичной репарации мутантной отцовской копии гена клетка чаще использовала в качестве матриц нормальную копию материнского генома, чем ДНК-матрицу, добавленную вместе с системой редактирования.
Гомологичная репарация мутации в геноме одного родителя с использованием генома другого родителя приводит к генной конверсии — замене участка ДНК на гомологичный. А это, в свою очередь, означает потерю гетерозиготности — комплементарные нити ДНК эмбриона становятся одинаковыми на протяженных участках, падает аллельное разнообразие. В большинстве случаев аллели матери и отца идентичны. Однако может случиться, что в этом участке у здорового родителя присутствует рецессивная мутация, которая способна вызвать заболевание, если присутствует в двух копиях. Она могла бы быть нейтрализована нормальным аллелем в геноме первого родителя, но этот аллель исчез при редактировании первой мутации.
В новой публикации авторы выбрали три гена-мишени: MYBPC3, ген MYH7, тоже связанный с гипертрофической кардиомиопатией, и ген LDLRAP1, мутация в котором ответственна за наследственное повышения уровня холестерина. Система CRISPR-Cas9 делала двухцепочечный разрыв в обеих копиях гена или же в одной (только в мутантном аллеле). На этапе 4-8 клеток отбирали бластомеры для секвенирования.
Редактирование проходило успешно, интактный аллель находился в обеих хромосомох, что подтвердила FISH-гибридизация. Но участки потери гетерозиготности оказались обширными — размер такого участка мог достигать 18 600 пар оснований. Авторы предполагают, что этому способствует асинхронность внесения двухцепочечных разрывов в материнские и отцовские аллели: из-за более плотной упаковки хроматина на ранних стадиях после оплодотворения аллели сперматозоидов могут быть менее доступными.
«Если у вас есть одна аномальная копия рецессивной мутации, это может не представлять риска, — комментирует Амато. — Но если у вас потеря гетерозиготности, ведущая к двум мутантным копиям одного и того же гена-супрессора опухоли, то у вас значительно повышен риск развития рака». Таким образом, исправление одной известной мутации может создать новые проблемы взамен решенных.
«Если вы режете середину хромосомы, там могут быть 2000 генов, — говорит Шухрат Миталипов. — Вы исправляете один крошечный кусок, но все эти тысячи генов выше и ниже могут быть затронуты».
Необходимо провести больше исследований, чтобы лучше понять механизм редактирования генов, прежде чем использовать его в клинических целях и имплантировать отредактированные эмбрионы, подчеркивают авторы статьи. Секвенирование стволовых клеток, полученных из клетки эмбриона и выращенных в культуре, также имеет ограничение, поскольку генетические варианты мозаичных эмбрионов могут не сохраниться.
Источники
Dan Liang, et al. Limitations of gene editing assessments in human preimplantation embryos // Nature Communications. 2023, 14:1219 DOI: 10.1038/s41467-023-36820-6
Цитаты по пресс-релизу


 Меню
Меню





 Все темы
Все темы



 0
0