Нокаут NF-κB в микроглии может усилить иммунотерапию метастатической меланомы
Несмотря на успехи иммунотерапии ингибиторами контрольных точек, она помогает не всем пациентам с метастатической меланомой. Затруднительно лечить, в частности, метастазы в мозг. Испанские ученые выяснили, что прогрессирование таких метастазов связано с активацией NF-κB в микроглии. Его ингибирование у мышей с помощью нокаута Rela — одной из субъединиц NF-κB — усиливало противоопухолевый иммунитет.
Меланома — крайне агрессивная форма рака кожи, которая способна метастазировать на ранних стадиях. Комбинированная терапия, основанная на ингибировании контрольных точек иммунитета, значительно улучшила прогноз для пациентов с метастатической меланомой, но многие пациенты по-прежнему не получают клинической пользы от такого лечения. В частности, большую проблему представляют метастазы в мозге. Ученые из Испании обнаружили, что с прогрессированием таких метастазов связана активация сигнального пути Rela/NF-κB в микроглии.
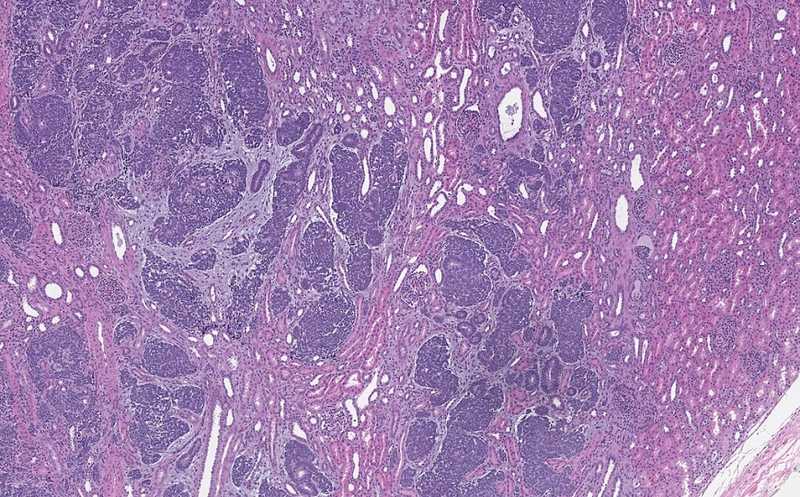
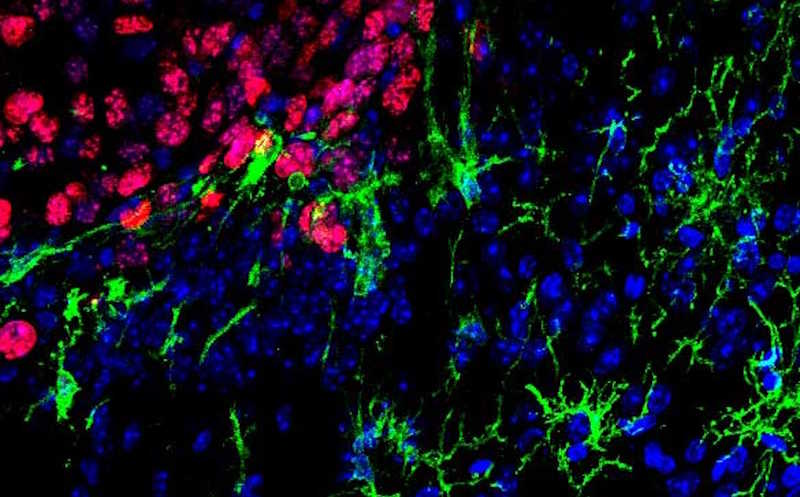
Опыты проводили на сингенной модели метастатической меланомы. Иммунокомпетентным мышам вводили во внутреннюю сонную артерию клетки меланомы мыши линии 1014 с мутацией NrasQ61K или B16F10. Эти клетки пигментированы, поэтому метастазы можно отслеживать без применения флуоресцентных маркеров (потенциально иммуногенных). Ткань метастазов в мозге оказалась обильно инфильтрирована клетками, экспрессирующими IBA1+ — классический маркер макрофагов мозга.
Для более детальной характеризации авторы провели секвенирование РНК единичных клеток (scRNA-seq) метастазов. Графовая кластеризация сгруппировала клетки в несколько популяций — олигодендроциты, их предшественники, астроциты, клетки кровеносных сосудов (эндотелиальные клетки и гладкомышечные клетки сосудов) и различные иммунные клетки, такие как T- или NK-клетки. Кроме того, UMAP выявил более высокую долю микроглии по сравнению с немикроглиальными миелоидными клетками. Основная часть макрофагов в метастазах была представлена резидентной микроглией (CX3CR1+/TMEM119+).
Предыдущие исследования показали, что макрофаги могут способствовать метастазированию в мозг. Чтобы изучить роль макрофагов в ранних этапах образования метастазов меланомы в мозге, ученые провели эксперименты на мышах, лишенных резидентной микроглии. CX3CR1+-клетки избирательно удаляли, индуцируя в них синтез дифтерийного токсина тамоксифеном. Проточная цитометрия показала, что пропорции остальных иммунных клеток в такой модели не менялись.
Интересно, что эффект удаления резидентной микроглии зависел от момента, когда это происходило. В образцах мозга мышей, которые лишились микроглии до трансплантации опухоли, наблюдалось больше очагов метастазирования, что указывало на ее противоопухолевую активность. Однако если микроглию истощали после введения опухолевых клеток, эффект был противоположным.
Чтобы изучить механизмы, обуславливающие такое наблюдение, авторы провели секвенирование РНК опухоль-ассоциированной микроглии (TA-MG) и макрофагов (TA-MAC), а затем сравнили их транскриптомные профили с таковыми у контрольных мышей.
Анализ главных компонент разделил на кластеры опухоль-ассоциированную и «нормальную» микроглию. Среди дифференциально экспрессируемых генов обнаружилось четыре кластера: гены трех из них повышались как в TA-MG, так и в TA-MAC, и были связаны с врожденными иммунными реакциями или клеточным циклом. В четвертом кластере сгруппировались гены, экспрессия которых возрастала только в микроглии, — они были ассоциированы с поддержанием нейронов и глиальных клеток или регулировкой гомеостаза.
В TA-MG ученые выявили обогащение генов сигнальных путей, связанных с NF-κB. Опираясь на это, они решили проанализировать экспрессию Rela — субъединицы p65 этого транскрипционного фактора — при метастатической меланоме. Делеция Rela в клетках микроглии после подсаживания опухоли снижала метастазирование, а сами клетки меланомы хуже пролиферировали. Резидентная микроглия, в отличие от опухоль-инфильтрирующих макрофагов, активно экспрессировала Rela. Дальнейший транскриптомный анализ показал, что микроглия перепрограммировалась в сторону канонического и провоспалительного фенотипов.
Нацеливание на NF-κB при этом усиливало противоопухолевый иммунитет: нокаут Rela приводил к увеличению количества CD8+ T- и NK-клеток.
Авторы предположили, что ответ пациентов на иммунотерапию ингибиторами контрольных точек может быть связан с NF-κB-сигналингом в микроглии. Они проанализировали данные scRNA-seq доступных образцов метастазирующей в мозг меланомы. Анализ функционального обогащения (GSEA) показал, что гены-мишени RELA и NFKB1 значительно активнее экспрессировались в опухоль-ассоциированных миелоидных клетках (в том числе микроглии) у тех пациентов, которые не ответили на терапию.
В совокупности эти результаты позволяют предположить, что перепрограммирование микроглии, вызванное воздействием на NF-κB, может повысить эффективность иммунотерапии у пациентов с метастатической меланомой.
Опухолевые макрофаги отследили с помощью нанотела к CD163
Источник
Francisco Javier Rodriguez-Baena, et al. Microglial reprogramming enhances antitumor immunity and immunotherapy response in melanoma brain metastases // Cancer Cell (2025). DOI: 10.1016/j.ccell.2025.01.008


 Меню
Меню





 Все темы
Все темы




 0
0