Новая CRISPR-Cas13 система — диагностическая и терапевтическая
Исследователи из Института Эли и Эдит Брод запрограммировали РНК-специфичную CRISPR-нуклеазу Cas13 на разрушение геномов РНК-содержащих вирусов внутри клеток млекопитающих и высокочувствительную детекцию вирусной РНК, остающейся после атаки Cas13. Технология, получившая название CARVER, — одна из первых, способных уничтожать вирусную РНК в живых клетках.
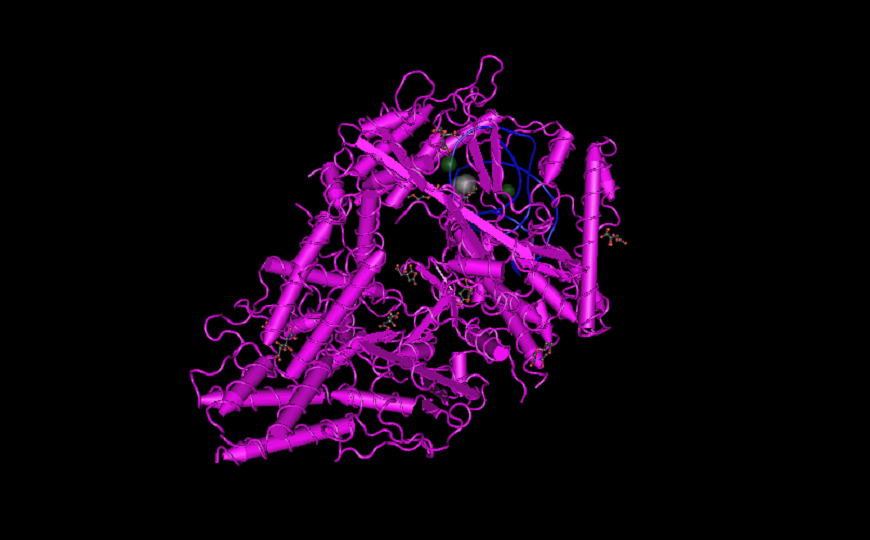
Один из ортологов Cas13 — Cas13b Prevotella buccae. Credit: NCBI
Создание противовирусных препаратов — задача существенно более сложная, чем разработка антибактериальных средств. В природе практически отсутствуют молекулы, способные инактивировать вирус, в то время как природные антибиотики и сами послужили средством для борьбы с бактериями, и стали матрицами для разработки синтетических препаратов. Против некоторых вирусов эффективна вакцинация, однако вариабельность многих из них делает разработку вакцин крайне сложной.
Новый подход к разработке препаратов против РНК-содержащих вирусов, предлагают сотрудники Института Эли и Эдит Брод в Массачусетсе. Для создания нового противовирусного средства коллектив использовал нуклеазу Cas13, которая, в отличие от широко известной ДНКазы Cas9, расщепляет полимеры РНК. (Собственно, в бактериях этот белок и отвечает за защиту от бактериальных вирусов — бактериофагов.) Компьютерный анализ показал, что в РНК различных патогенных вирусов достаточно много сайтов, пригодных для атаки Cas13. В качестве моделей для исследования были выбраны вирусы везикулярного стоматита, гриппа А и лимфоцитарного хориоменингита (LCMV). Средства терапии ни для одного из этих вирусов не разработаны.
В клетках, трансфицированных Cas13 и РНК-гидами, специфичными к РНК вирусов, титр вирусных частиц снижался по сравнению с контрольными клетками; в случае вируса гриппа — в 300 раз. Возможно и дальнейшее повышение эффективности Cas13: нуклеаза может процессировать молекулу РНК, содержащую до 4 индивидуальных РНК-гидов, специфичных к различным мишеням в составе вируса. Кумулятивный эффект при одновременной атаке нескольких сайтов может повысить эффективность действия Cas13 на порядки.
Не все сайты в составе вирусных РНК, идентифицированные при компьютерном анализе, обеспечивали продуктивную атаку вирусной РНК комплексом Cas13/РНК-гид. Чтобы понять, как отбирать эффективные РНК-гиды, исследователи проанализировали множество сайтов РНК вируса LCMV, потенциально пригодных для атаки Cas13. Выяснилось, что наибольшее число активных сайтов находится в консервативных участках вирусной РНК, и что таких сайтов значительно больше в антисмысловой цепи РНК, чем в смысловой. Исследователи также отметили, что Cas13 не вызывает формирования устойчивости в течение нескольких циклов репликации, в отличие от противовирусной нуклеазы на основе Cas9, которая в ряде случаев вызывает селекцию устойчивых мутантов в течение 40 часов после инфекции.
Интересная особенность Cas13 — после активации в присутствии РНК-мишени включается ее неспецифическая активность, она расщепляет и другие молекулы РНК. Этой особенностью в Институте Бродов ранее воспользовались для создания высокочувствительного диагностического инструмента под названием SHERLOCK: Cas13, активированная мишенью (определенной вирусной РНК), расщепляет репортерные молекулы РНК, индуцируя флюоресцентный сигнал. SHERLOCK позволяет быстро детектировать аттомолярные количества РНК-мишени. (Подробнее о методе в интервью с Дмитрием Грядуновым.)
В новой работе авторы использовали Cas13 и для уничтожения вирусных РНК, и параллельно — для их детекции и количественной оценки, создав объединенную платформу CARVER (Cas13-assisted restriction of viral expression and readout). Методом SHERLOCK они измеряли уровень вирусных РНК в супернатанте клеточной культуры после обработки Cas13, а также детектировали однонуклеотидную мутацию в геноме LCMV, связанную с переходом от острой инфекции к персистирующей.
Исследователи показали, что неспецифическая нуклеазная активность Cas13 не влияла на жизнеспособность клеток в культуре. Можно предположить, что при расщеплении клеточных транскриптов включаются компенсаторные механизмы, поскольку матрица с которой происходит считывание – клеточная ДНК – никак не повреждается.
Авторы работы уверены, что на основе созданной ими системы можно будет создавать терапевтические средства, блокирующие размножение широкого спектра вирусов, и в то же время оценивать эффективность терапии. Кроме того, по их мнению, уже сейчас Cas13 является ценным инструментом для изучения жизненного цикла патогенных РНК-содержащих вирусов. Пока, однако, не решен вопрос доставки Cas13, даже на мышах — эксперименты проводились лишь на клеточных культурах.
Источник
Freije CA, Myhrvold C, et al. // Programmable inhibition and detection of RNA viruses using Cas13.// Molecular Cell. Online October 10, 2019. DOI: 10.1016/j.molcel.2019.09.013


 Меню
Меню





 Все темы
Все темы




 0
0