Новая платформа для редактирования митохондриального генома
В 2020 году был создан редактор оснований DdCBEs, который позволяет заменить C на T в митохондриальном геноме. В новой работе описана платформа TALED (transcription activator-like effector-linked deaminases), которая катализирует замену A на G, что позволит отредактировать 39 из 90 известных патогенных точечных мутаций с высокой эффективностью. TALED не влияет на жизнеспособность клетки, уровень митохондриальной ДНК или функции митохондрий.
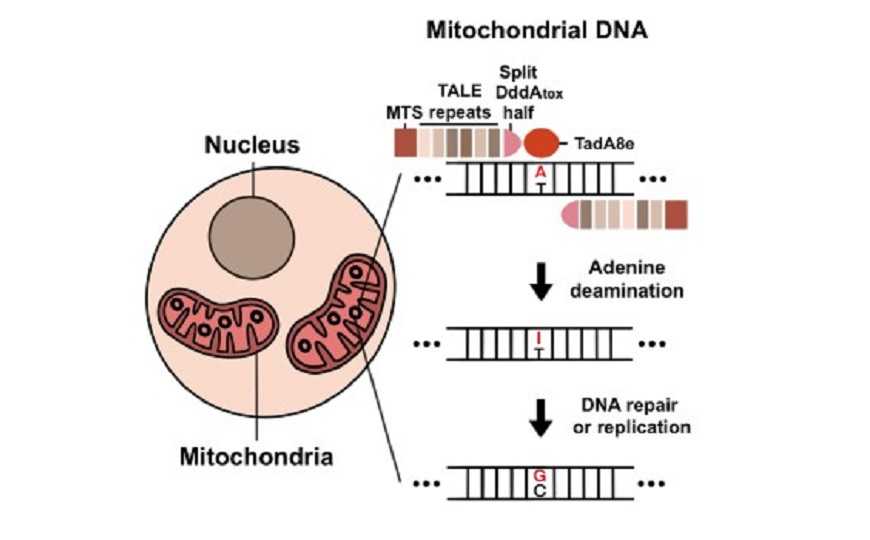
Некоторые наследственные заболевания вызваны мутациями в митохондриальном геноме. Развитие технологий генного редактирования важно не только для терапии, но и для создания животных моделей человеческих болезней. Платформа CRISPR-Cas не подходит для этих целей, так как гидРНК не может проникнуть в митохондрию. В 2020 году был создан редактор оснований DdCBEs (DddA-derived cytosine base editors), который способен заменять C на T в контексте TC-мотива без разрыва цепи ДНК (подробнее — на PCR.NEWS). Однако с его помощью можно отредактировать только 9 из 90 известных патогенных точечных мутаций митохондриального генома. В новой работе описана платформа, способная заменять A на G, что позволит отредактировать еще 39 патогенных мутаций.
Новую платформу назвали TALED (transcription activator-like effector-linked deaminases). Она состоит из трех компонентов: TAL-эффектора (TALE), который таргетирует последовательность ДНК, адениндезаминазы TadA8e, которая способствует замене A на G, и цитидиндезаминазы DddAtox, которая облегчает работу TadA8e. Дезаминаза TadA8e — производная TadA Escherichia coli, а DddAtox была получена из Burkholderia cenocepacia. TadA8e ранее не использовали в этом контексте, поскольку считалось, что она способна работать только с одноцепочечной ДНК.
Сначала авторы показали на клетках HEK 293T, что TALE, связывающий гены ND1 или ND4, и TadA8e способны катализировать замену A на G, но с очень низкой эффективностью (0,7–1,2%). Добавив DddAtox, исследователям удалось значительно повысить эффективность редактирования до 10–33%. При этом DddAtox сконструирована таким образом, чтобы избежать ее цитотоксичности и подавить каталитическую активность. Для этого DddAtox поделили на две части, каждая из которых пришита к своему TALE, и убрали UGI — домен, подавляющий вырезание урацила. Дальнейшие эксперименты показали, что конструкция с одним полноразмерным мутантным DddAtox тоже работает. Далее в опытах использовали мономерные, димерные и разделенные TALED: mTALED, dTALED и sTALED. Самым эффективным был sTALED, не не во всех случаях. Его эффективность была близка к DdCBEs. При этом присутствие TC-мотива не было обязательным.
Авторы показали, что можно получить клоны одной измененной клетки. TALED не влияет на жизнеспособность клетки, уровень митохондриальной ДНК или на функции митохондрий. Эффективность редактирования гена RNR2 показали также на клеточных линиях HT1080 и HCT116. Отбором с помощью хлорамфеникола можно повысить частоты редактирования до 92% и 87% через 30 дней после применения TALED. Без отбора частоты не меняются со временем. Таким образом, мутации, индуцированные TALED в гене RNR2, дают защиту от хлорамфеникола.
Также охарактеризовали нецелевое редактирование с помощью секвенирования. Частоты такого редактирования в митохондриальном геноме варьировали от 0,013% до 0,025%, что сравнимо с DdCBE (0,010–0,018%). mTALED и dTALED были точнее sTALED. Все TALED содержат MTS (mitochondrial targeting sequence), поэтому не было обнаружено признаков нецелевого редактирования ядреного генома.
Источник
Sung-Ik Cho, et al. Targeted A-to-G base editing in human mitochondrial DNA with programmable deaminases // Cell (2022), published April 25, 2022, DOI: 10.1016/j.cell.2022.03.039


 Меню
Меню





 Все темы
Все темы




 0
0








