Новые липидные наночастицы избирательно доставляют мРНК в мышцы
Липидные наночастицы (ЛНЧ) используют для доставки РНК-препаратов в клетки, однако проблемой остается недостаточная тканевая специфичность. Ученые из Университета Торонто разработали платформу для синтеза компонентов ЛНЧ и изучили частицу, содержащую новый ионизируемый липид. Этот носитель успешно доставляет мРНК в мышечные ткани, а нецелевые эффекты значительно снижены по сравнению с ЛНЧ, применяемыми в вакцинах Moderna. Новые ЛНЧ могут быть использованы в разработке терапевтических мРНК-вакцин.
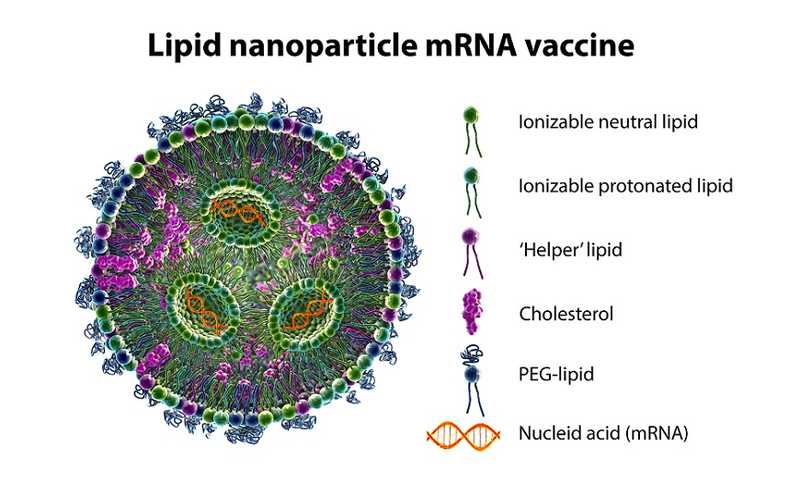
Очередную перспективную модификацию липидных наночастиц (ЛНЧ) для доставки РНК в клетки предложили канадские исследователи. Их работа опубликована в PNAS.
В настоящее время Управление по контролю продуктов и лекарств США (FDA) одобрило три препарата, активное вещество которых представляет собой РНК в составе ЛНЧ. Онпаттро (патисиран) компании Alnylam, препарат для лечения периферической полинейропатии, содержит интерферирующую РНК. (Другие РНК-препараты от Alnylam — гивосиран, лумасиран, вутрисиран, инклисиран, — не используют ЛНЧ, РНК в них конъюгирована с N-ацетилгалактозамином, распознаваемым рецептором клеток печени.) Всем известны две мРНК-вакцины против SARS-CoV-2 — Comirnaty (Pfizer‑BioNTech) и Spikevax (Moderna).
Нецелевая доставка липидных наночастиц с РНК в печень или сердце может быть опасной. Авторы статьи ссылаются на документы Европейского медицинского агентства, в которых описаны единичные случаи временного повышения концентрации ферментов печени в крови у пациентов, вакцинированных Comirnaty (см., например, отчет от 2022 года). Поэтому ведется поиск новых ЛНЧ для высокоспецифичной доставки мРНК и минимизации нецелевых эффектов.
Классический «рецепт» ЛНЧ включает четыре компонента. Ионизируемые липиды связывают мРНК, стабилизируют ее во внутренней среде организма, а затем облегчают выход мРНК из эндосомы, обеспечивают доставку в цитозоль клетки; они также снижают токсичность частицы. Хелперные фосфолипиды и холестерин поддерживают структуру и стабильность частицы, облегчают слияние частиц с клетками. Липиды, связанные с полиэтиленгликолем (ПЭГилированные липиды), предотвращают агглютинацию частиц. Ключевую роль в эффективности мРНК-препаратов играют ионизируемые липиды. В одобренных FDA препаратах они уникальны.
Ученые из Университета Торонто представили высокопроизводительную систему одностадийного синтеза ионизируемых липидов, которая поможет в дальнейшем проектировании и оценке эффективности ЛНЧ. Методом комбинаторной химии они получили библиотеку ионизируемых липидов и выбрали наиболее эффективный — iso-A11B5C1. ЛНЧ, содержащие этот липид, лучше всего подходят для таргетной доставки мРНК в мышцы.
Эффективность трансфекции и биораспределение iso-A11B5C1-ЛНЧ сравнивали с показателями для SM-102 — «эталонной» ЛНЧ, которая входит в состав вакцины против COVID-19 Spikevax. В экспериментах на мышах разницы в эффективности трансфекции в месте инъекции не наблюдались. iso-A11B5C1 не обнаруживалась в нецелевых органах, в отличие от частицы SM-102, которая показала высокую трансфекцию и накопление в печени и селезенке. Иначе говоря, новая ЛНЧ специфична для мышечной ткани.
Трансфекцию изучили in vitro на клеточной линии HeLa, HepG2 (гепатоциты) и клетках селезенки. Трансфекция iso-A11B5C1-ЛНЧ по сравнению с ЛНЧ компании Moderna оказалась в 42 раза выше в клетках HeLa, в 28 раз ниже в линии HepG2 и в 24 раза ниже в спленоцитах. Эффективность трансфекции новой частицы в мышечной ткани была высокой как in vitro, так и in vivo, с минимальной нецелевой трансфекцией.
Исследователи провели испытания частицы iso-A11B5C1 для различных приложений — тканеспецифичного редактирования генов, доставки мРНК-вакцины и мРНК-терапевтических препаратов.
В экспериментах по редактированию iso-A11B5C1-ЛНЧ и SM-102-ЛНЧ содержали мРНК Cre-рекомбиназы, тот или другой препарат вводили генноинженерным репортерным мышам. Уровень редактирования генов, специфичных для мышц, в местах внутримышечной инъекции был сопоставимым в местах инъекций для частиц iso-A11B5C1 и SM-102. В группе мышей с SM-102-ЛНЧ отмечали высокий уровень нецелевого редактирования в печени (83,83% клеток) и селезенке (72,67%), но при использовании iso-A11B5C1 редактирование в этих тканях не обнаруживалось.
По сравнению с показателями частицы SM-102, iso-A11B5C1 стимулировала более слабый гуморальный (титр IgG был в 10 раз ниже), но сопоставимый клеточный иммунный ответ (сходный уровень интерферона-γ, IL-1b, IL-6). Эффективность трансфекции в дендритных клетках снижалась, как и экспрессия CD86 или CD40 на них. Это может означать, что новая ЛНЧ имеет более низкую способность стимулировать созревание дендритных клеток.
Потенциал iso-A11B5C1-ЛНЧ для терапевтических вакцин оценивали на модели меланомы у мышей. Новые ЛНЧ замедляли рост опухоли, повышали уровни CD8+ Т-клеток и их инфильтрацию в опухоль, но по способности замедлять рост опухоли iso-A11B5C1-ЛНЧ не превзошла SM-102-ЛНЧ.
Разработанная на новой платформе липидная наночастица с iso-A11B5C1 может быть полезной для создания терапевтических вакцин на основе мРНК. Авторы подчеркивают, что высокая эффективность трансфекции иммунных клеток не единственный критерий качества — тканевая специфичность и безопасность не менее важны.
Источник
Chen, J. et al. Combinatorial design of ionizable lipid nanoparticles for muscle-selective mRNA delivery with minimized off-target effects // PNAS. 120 (50) e2309472120 (2023). DOI: 10.1073/pnas.2309472120


 Меню
Меню





 Все темы
Все темы




 0
0