Новый класс антиретровирусных препаратов может безопасно нейтрализовать ВИЧ в мозге
Серьезную проблему в терапии ВИЧ представляет проникший в мозг вирус — многие препараты для антиретровирусной терапии либо неспособны проходить через гематоэнцефалический барьер, либо токсичны для нейронов. Выходом из положения может стать результат работы международного коллектива ученых — синтезированное ими соединение способно проникать через ГЭБ и нейтрализовать вирус внутри нейронов, не оказывая при этом токсического воздействия на клетки.
Credit:
123rf.com
Совместная работа ученых из России, Италии и США открывает новые грани лечения ВИЧ-инфекции. Исследователи синтезировали и охарактеризовали соединение, которое может стать важным дополнением для существующего арсенала высокоактивной антиретровирусной терапии (ВААРТ), применяемой в современной клинической практике для лечения ВИЧ.
ВААРТ основывается на комбинации антиретровирусных препаратов различного действия. Как правило, применяют нуклеозидные или ненуклеозидные ингибиторы обратной транскриптазы (NRTI и NNRTI, соответственно), ингибиторы интегразы (integrase strand transfer inhibitors, INSTI) или ингибиторы протеаз. В целом такой подход показал высокую эффективность в терапии ВИЧ, однако у ряда пациентов сохраняется небольшой уровень виремии. Она, в свою очередь, увеличивает риск вирусологической неудачи, передачи вируса или приобретения им устойчивости к препаратам. Важную роль тут играет мутационная изменчивость вируса — за счет высокой склонности к мутациям он может приобретать устойчивость к тем или иным препаратам (например, часто в клинике регистрируют мутации, приводящие к устойчивости к NNRTI). Кроме того, у ряда пациентов возникают серьезные осложнения, отдельной группой которых являются ВИЧ-ассоциированные нейрокогнитивные расстройства. Среди их причин у пациентов на АРТ называют неспособность препаратов проникнуть через гематоэнцефалический барьер (ГЭБ) или их нейротоксичность.
Таким образом, для повышения эффективности антиретровирусной терапии в дальнейшем необходимо разработать препарат, обладающий минимальным количеством побочных эффектов (в том числе без нейротоксичности) и способный проникать через ГЭБ, а также активный в отношении основных резистентных к существующим препаратам штаммов.
В качестве кандидата авторы опубликованной в Journal of Medicinal Chemistry статьи предложили ненуклеозидный ингибитор обратной транскриптазы на основе N-фенил-1-(фенилсульфонил)-1H-1,2,4-триазол-3-амина. Предварительно на платформе Университета Кальяри был проведен скрининг большого количества соединений, и с его помощью выявлены те из них, которые обладали специфической активностью в отношении обратной транскриптазы вируса.
Показав, что исходная структура обладает нужной активностью, исследователи проанализировали зависимость активности вещества от структуры (structure−activity relationship, SAR — классический метод, используемый в лекарственной химии), чтобы оптимизировать эффективность препарата в отношении ВИЧ дикого типа и основных мутантных штаммов (например, А17, несущего замены K103N/Y181C в последовательности ревертазы). Химическим модификациям подвергали три участка молекулы, оценивая влияние того или иного структурного изменения на антиретровирусную активность и комбинируя полученные модификации.
Изначальный скрининг активности полученных синтетических производных против ВИЧ дикого типа и А17 проводили на клеточной линии TZM-bl. Каждое из отобранных кандидатных соединений тестировали на активность против дикого типа ВИЧ-1 (IIIB) и против штамма А17 (исходный препарат значимой ингибирующей активностью против А17 не обладал). Кроме того, для них определяли дозозависимую цитотоксичность в диапазоне 0,5−500 нМ, и значимых цитотоксических эффектов выявлено не было.
Для подтверждения того, что кандидатные соединения активны против ВИЧ-1 именно за счет ингибирования обратной транскриптазы, авторы проводили количественное окрашивание двуцепочечной ДНК. Тестируемые препараты действительно препятствовали накоплению вирусной ДНК, что подтверждает их действие на ревертазу вируса.
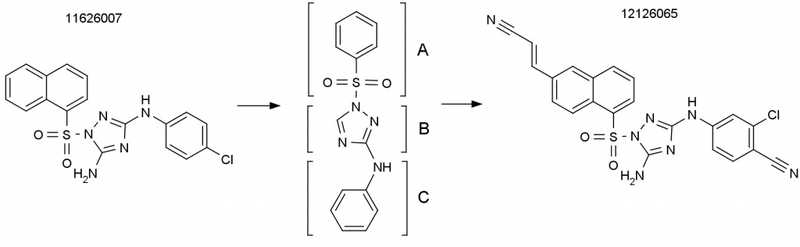 Исходная и оптимизированная структура препарата, ингибирующего ревертазу ВИЧ. Основа структуры, состоящая из трех ключевых фрагментов (A, B и C), представлена по центру — исследуя ее свойства и их изменение в зависимости от вносимых модификаций, ученые получили соединение 12126065, обладающее наибольшим потенциалом для нейтрализации ВИЧ-1 в нейронах.
Исходная и оптимизированная структура препарата, ингибирующего ревертазу ВИЧ. Основа структуры, состоящая из трех ключевых фрагментов (A, B и C), представлена по центру — исследуя ее свойства и их изменение в зависимости от вносимых модификаций, ученые получили соединение 12126065, обладающее наибольшим потенциалом для нейтрализации ВИЧ-1 в нейронах.
Для наиболее перспективного в отношении дикого и мутантного штаммов ВИЧ-1 вещества (соединение 12126065) ученые провели in vitro анализ абсорбции, распределения, метаболизма и выведения (ADME — Absorption, Distribution, Metabolism, Excretion) в сочетании с оценкой токсичности. Авторы работы отметили его низкую водорастворимость, которая, однако, является типичной для многих NNRTI и на фармакокинетике не сказалась. Сам препарат является метаболически стабильным, накапливается в микросомах печени и демонстрирует достаточно низкий уровень ингибирования цитохромов P450.
Ингибирование hERG (альфа-субъединица калиевого канала кардиомиоцитов, по всей видимости, ее ингибирование определяет кардиотоксичность) было на низком уровне, и дальнейшие результаты позволяют предположить, что оно осуществлялось за счет неспецифического связывания.
Нейротоксичность оценивали на первичных нейронах мыши, которые обрабатывали анализируемыми препаратами в различных дозировках. Эффект оценивали окрашиванием на MAP2 (ассоциированный с микротрубочками белок, экспрессирующийся в нейронах) и анализом накопления ионов кальция.
Для оценки безопасности препаратов авторы предложили специальный индекс (s-index), основанный на оценке токсической концентрации (TC10 — концентрация, при которой наблюдается 10% снижение количества MAP2) и максимальной терапевтической концентрации (авторы дают оценку 100 × EC50, где EC50 — полумаксимальная эффективная концентрация). Сам индекс вычисляется по формуле S = TC10 / (100 × EC50). Исследователи говорят, что значения ≤1 указывают на вероятный риск токсических эффектов. Для наиболее перспективного кандидата, 12126065, s-индекс вычислить не удалось, поскольку нейротоксических эффектов, влияющих на количество MAP2, не наблюдалось.
Препарат хорошо переносится животными (по результатам 30-дневного исследования на мышиной модели последствий токсического воздействия на организм выявлено не было, за исключением воздействия на печень в дозировке 250 мг/кг).
— Даже в высоких концентрациях мы не имеем каких-то токсических эффектов, поэтому при применении высоких доз препарата мы можем рассчитывать на то, что уничтожим вирус в его логове, — комментирует Вадим Макаров, доктор фармацевтических наук, зав. лабораторией биомедицинской химии ФИЦ РАН и соведущий автор публикации.
Кроме того, авторы исследования охарактеризовали полученные соединения с точки зрения совокупности их свойств. Для этого они сопоставили данные о свойствах этих веществ ( extended connectivity fingerprint, ECFP6) с публичными датасетами веществ с анти-ВИЧ-активностью. Уменьшение размерности полученного пространства характеристик при помощи tSNE сгруппировало новые соединения в отдельный кластер — такие результаты позволяют говорить, что в ходе данной работы авторы получили новый класс веществ.
В конечном счете исследователи разработали новый класс NNRTI, эффективный в отношении как дикого типа ВИЧ-1, так и его мутантных штаммов, обладающих резистентностью к другим препаратам. Вадим Макаров подчеркивает, что в данном случае велась прежде всего фундаментальная работа. На соединение-лидер, конечно, уже зарегистрирован международный патент, однако стоит помнить о том, что переход к клиническим испытаниям и потенциальное внедрение препарата в медицинскую практику — это отдельный серьезный этап, который потребует немало времени и ресурсов. По словам Макарова, уже есть немало препаратов против ВИЧ, которые приносят доход фармацевтическим компаниям. Далеко не каждая фармкомпания будет готова быстро браться за новое, пусть даже и более эффективное лекарство. Главной целью нынешней работы было показать, что это в принципе возможно — создать препарат, который можно будет «протащить через гематоэнцефалический барьер и затем загнать внутрь нейрона, чтобы инактивировать вирус уже внутри клетки».
Источник
Lane, T. et al. N-Phenyl-1-(phenylsulfonyl)-1H-1,2,4-triazol-3-amine as a New Class of HIV-1 Non-nucleoside Reverse Transcriptase Inhibitor // J Med Chem, 2023. DOI: 10.1021/acs.jmedchem.2c02055


 Меню
Меню





 Все темы
Все темы



 0
0