Новый онколитический вирус увеличивает эффективность иммунотерапии рака
Разработан онколитический вирус на основе вируса осповакцины, который кодирует ингибитор иммуносупрессивного цитокина TGF-β. Этот вирус в сочетании с ингибитором контрольных точек вызвал исчезновение агрессивной меланомы у 67% мышей. Планируются клинические исследования комбинаций онколитического вируса с иммунотерапией.
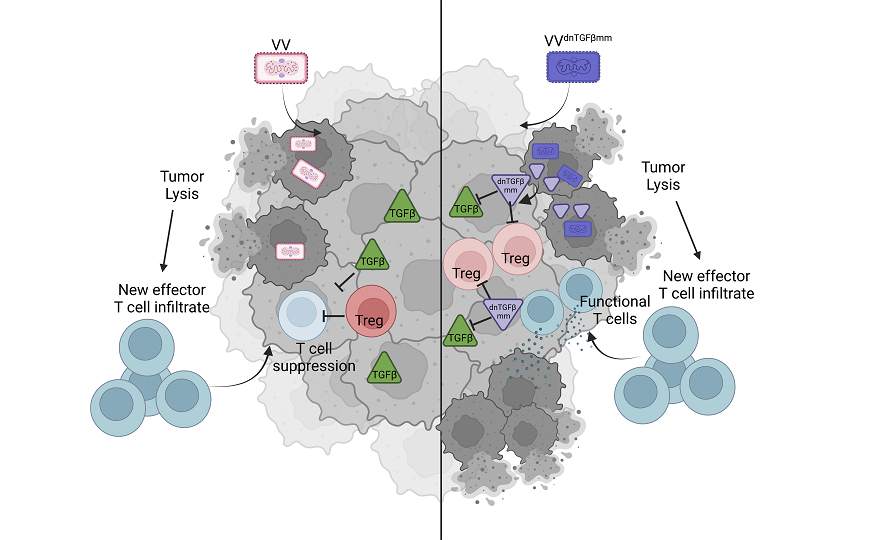
Онколитический вирус в любом случае привлекает в опухоль эффекторные Т-клетки (слева), но если этот вирус экспрессирует ингибитор TGF-β, то опухоль разрушается активнее за счет подавления регуляторных Т-клеток (справа)
Credit:
J Exp Med. 2023. DOI: 10.1084/jem.20230053 | CC BY 4.0
Онколитические вирусы (ОВ) — модифицированные вирусы, которые избирательно поражают быстро делящиеся опухолевые клетки. Первоначально они были разработаны для непосредственного уничтожения раковых клеток; в настоящее время в США одобрен для лечения меланомы препарат талимоген лагерпарепвек (T-VEC, Imlygic) — онколитический вирус герпеса. Он испытывается и при других видах рака. Но позже исследователи заметили, что ОВ стимулируют иммунную систему и их можно использовать в сочетании с другими методами лечения рака, которые способствуют иммунному ответу на опухоль, такими как ингибиторы иммунных контрольных точек.
«Ингибиторы иммунных контрольных точек работают только в “горячих” опухолях, которые уже инфильтрованы Т-клетками. Онколитические вирусы могут помочь “согреть” холодные опухоли», — сказал Грег Дельгофф из Питсбургского университета, руководитель исследования, в ходе которого был создан новый онколитический вирус. С другой стороны, опухоли многих пациентов не реагируют на онколитические вирусы, что мешает их применению в клинике.
ОВ могут доставлять в клетки опухоли геннотерапевтический агент (например, в случае T-VEC это ген GM-CSF, способствующий рекрутированию антигенпрезентирующих клеток). Но так как ОВ сами по себе способствуют иммунной инфильтрации, интересно было бы использовать другие механизмы.
Чтобы понять, чем обусловлена устойчивость опухоли к вирусам, исследователи создали две клеточные линию плоскоклеточного рака головы и шеи (HNSCC). Одна была очень чувствительной к онколитическому вирусу на основе вируса осповакцины — опухоли регрессировали уже после однократной инъекции вируса; вторая была устойчивой к вирусной терапии. Те и другие клетки вводили мышам и сравнивали иммунологические различия в растущих опухолях. Оказалось, что резистентность связана с высоким содержанием иммуносупрессивного цитокина TGF-β — сигнального белка, который может способствовать росту опухоли, подавляя иммунный ответ (в частности, снижая чувствительность к интерферону гамма). Также в резистентной опухоли была более стабильной активность регуляторных Т-клеток, подавляющих иммунный ответ, а активность цитотоксических Т-клеток, напротив, снижена.
После этого исследователи разработали вирус осповакцины с геном, кодирующим ингибитор рецептора TGF-β. Ингибиторы TGF-β очень эффективны, но при системном введении токсичны, что ограничивает их применение в клинике, объясняет Грег Дельгофф. Онколитические же вирусы доставляют ингибитор непосредственно в микроокружение опухоли, что снижает токсичность. (В данном случае ингибитором был небольшой мономерный фрагмент TGFβ, который связывался с рецептором TGFβRII эффективнее, чем эндогенный TGFβ, и подавлял его активность.)
Когда авторы работы вводили модифицированную осповакцину мышам с устойчивым к вакцине HNSCC, опухоли уменьшались; примерно у половины мышей они исчезли полностью. Выживаемость была существенно больше, чем у мышей, которые получали контрольный вирус без гена ингибитора TGF-β. Лечение не вызывало аутоиммунных или связанных с токсичностью побочных эффектов.
Затем исследователи проверили, могут ли модифицированные вирусы работать аналогичным образом при очень агрессивной форме меланомы, устойчивой к ингибиторам иммунных контрольных точек анти-PD1. Все животные, которые не получали лечения, получали только анти-PD1 или контрольный вирус на основе осповакцины, умерли в течение 24 дней, в то время как около 20% животных, получивших модифицированный вирус, полностью избавились от опухоли и остались живы до конца наблюдения.
Наиболее эффектные результаты были получены, когда модифицированную осповакцину комбинировали с анти-PD1. У 67% мышей опухоли полностью исчезли, и выживаемость значительно увеличилась.
Дельгофф и его коллеги передали лицензию на свой модифицированный вирус компании Kalivir Immunotherapys, сообщается в пресс-релизе. Предполагается, что вскоре будут начаты клинические испытания этого вируса в качестве адъюванта для ингибиторов иммунных контрольных точек у пациентов с опухолями, резистентными к этим иммунотерапевтическим препаратам.
Комбинация вирусной и иммунотерапии вызывает гибель раковых клеток по необычному пути
Источники
Kristin DePeaux, et al. An oncolytic virus–delivered TGFβ inhibitor overcomes the immunosuppressive tumor microenvironment // Journal of Experimental Medicine. 2023. 220 (10): e20230053. DOI: 10.1084/jem.20230053
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0







