Новый селективный антибиотик щадит микробиом кишечника
Ученые из США создали антибиотик лоламицин, специфичный к грамотрицательным патогенам человека. Нацеленный на систему транспорта липопротеинов (Lol), он убивал многие патогенные штаммы энтеробактерий, в том числе с множественной лекарственной устойчивостью, но не нарушал естественную микробиоту подопытных мышей.
Инфекции, вызванные грамотрицательными патогенами, обычно лечат антибиотиками широкого спектра. Это нарушает микробиом мишечника и может повышать восприимчивость к вторичным инфекциям, поэтому существует острая потребность в антибиотиках, селективных в отношении грамотрицательных или грамположительных бактерий, а также избирательно действующих на патогены. Исследователи из Иллинойсского университета в Урбане-Шампейне разработали лоламицин — специфичный к грамотрицательным бактериям антибиотик, нацеленный на систему транспорта липопротеинов.
Авторы работы выбрали в качестве мишени систему Lol — пятикомпонентную белковую систему, свойственную грамотрицательным бактериям. Ее белки располагаются в периплазматическом пространстве и обеспечивают транспорт липопротеинов между внутренней и внешней мембранами. В систему входят периплазматический шаперон LolA, рецептор LolB, а также три белка, образующих транспортерный комплекс — C, D и E. При этом именно LolCDE, как показали исследования, служит обязательным и ключевым компонентом системы, поэтому ученые выбрали его в качестве основной мишени.
Скрининг, проведенный компанией AstraZeneca в 2015 году, выявил потенциальные ингибиторы LolCDE — пиридинпиразолы и пиридиннимидазолы, — однако они обладали плохой растворимостью и оказались недостаточно эффективны in vivo. На основе этих двух структур исследователи получили гибридный скаффолд, внесли несколько модификаций, чтобы оптимизировать активность соединения, и в итоге синтезировали лоламицин. Он обладал выраженной активностью в отношении грамотрицательных бактерий, включая Escherichia coli, Klebsiella pneumoniae и Enterobacter cloacae, но не Pseudomonas aeruginosa дикого типа.
Затем авторы статьи оценили эффективность лоламицина на обширной панели клинических изолятов E. coli, K. pneumoniae и E. cloacae с множественной лекарственной устойчивостью. Протестированные штаммы были резистентны к таким антибиотикам, как карбапенемы, аминогликозиды, сульфаниламиды, триметоприм, тетрациклины и колистин. Лоламицин в этом исследовании убивал 50% штаммов E. coli в концентрации 1–2 мкг/мл, 90% штаммов — в концентрации 4 мкг/мл, а в концентрации 8 мкг/мл действовал против всех штаммов.
Ученые задались вопросом о возможном механизме действия и устойчивости бактерий к препарату. Они получили ряд мутантных штаммов, часть из которых была резистентна к лоламицину. Затем авторы секвенировали локус lol из устойчивых колоний и выявили 9 различных мутаций у резистентных E. coli и 8 — у K. pneumoniae. Эти мутации были связаны с отдельными аминокислотными заменами в белках LolC и LolE.
Идентифицировав ключевые мутации, связанные с резистентностью, исследователи прибегли к молекулярному моделированию, чтобы установить сайт связывания лоламицина в LolCDE и детальнее определить механизм ингибирования этой системы антибиотиком. Оказалось, что в выявленных сайтах связывания лоламицин контактирует с теми же аминокислотыми остатками, которые взаимодействуют с липопротеином. По-видимому, механизм действия лоламицина заключается в конкурентном ингибировании липопротеинового транспорта.
Следующим шагом работы стали эксперименты in vivo. Ученые протестировали лоламицин на двух мышиных моделях инфекции — острой пневмонии и септицемии. В качестве контроля использовали соединение из класса пиридинпиразолов. Мышей заражали клиническим изолятом E. coli, устойчивым к колистину. Бактериальная нагрузка в модели острой пневмонии у мышей снижалась на два порядка при применении лоламицина, при этом все мыши с септицемией выжили, тогда как пиридинпиразоловый препарат справлялся с инфекцией куда хуже. Аналогичные эксперименты показали эффективность лоламицина против колистинрезистентной K. pneumoniae, карбапенемрезистентной K. pneumoniae и колистинрезистентной E. cloacae. Также лоламицин хорошо переносился мышами при пероральном введении (дозировка 200 мг/кг), демонстрировал при этом значительную биодоступность и эффективность против патогена — более 70% мышей с сепсисом выжили при таком режиме дозирования.
Наконец, исследователи показали, что пероральное введение нового антибиотика не нарушает естественную микробиоту кишечника. Чтобы это проверить, здоровым мышам перорально вводили амоксициллин (антибиотик широкого спектра действия), клиндамицин (действует только на грамположительных бактерий) или лоламицин. Животные получали препарат в течение трех дней. Образцы фекалий собирали до начала лечения (день 0), через 4 дня после окончания приема (день 7), а также через неделю и через 28 дней после окончания терапии (дни 10 и 31, соответственно). Состав микробиома определяли с помощью секвенирования 16S рибосомальной РНК, и анализ показал, что прием амоксициллина и клиндамицина существенно изменил популяции бактерий, населявших кишечник мышей. Так, возросла доля бактерий из семейств Enterobacteriaceae и Tannerellaceae, тогда как представителей Bacteroidaceae, Acholeplasmataceae, Lachnospiraceae и Muribaculaceae стало меньше. В отличие от этого, прием лоламицина не вызвал существенных изменений в таксономическом составе микробиома. Кроме того, мыши, получившие курс лоламицина, были устойчивы к вторичной инфекции, вызываемой Clostridioides difficile.
Лоламицин, таким образом, продемонстрировал активность против патогенных Enterobacteriaceae, но не убивал комменсальные бактерии кишечника мыши. Авторы заключают: поскольку микробиом кишечника крайне важен для поддержания здоровья хозяина, в клиническую практику необходимо вводить щадящие антибиотики, такие как лоламицин — это позволит минимизировать ущерб, наносимый микробиому кишечника при лечении.
Антибиотик узкого спектра действия обнаружен при помощи машинного обучения
Источник
Muñoz, K.A., et al. A Gram-negative-selective antibiotic that spares the gut microbiome. // Nature (2024). DOI: 10.1038/s41586-024-07502-0


 Меню
Меню





 Все темы
Все темы
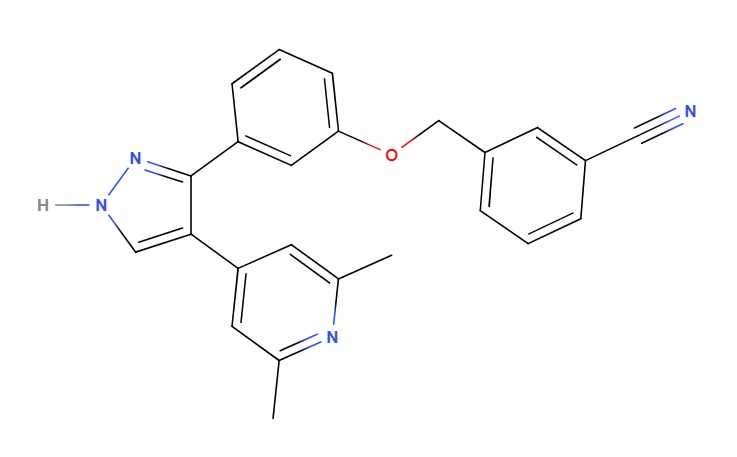 Структурная формула лоламицина.
Структурная формула лоламицина.



 0
0







