Объем пересаженных бета-клеток вырос в семь раз под действием двух препаратов
Среди методов терапии диабета рассматривают в том числе пересадку производящих инсулин бета-клеток. Исследователи из США показали, что ингибиторы DYRK1A (гармин) в комбинации с агонистами рецепторов глюкагоноподобного пептида 1 (эксендин 4) в семь раз увеличивают объем бета-клеток, пересаженных мышам без иммунитета. Терапия способствует выживанию бета-клеток в первые дни после трансплантации, а также активирует их пролиферацию. Эффект сохранялся в течение трех месяцев терапии и еще месяц после прекращения лечения. Мыши не испытывали гипогликемии при увеличении количества бета-клеток. Эффект препаратов впервые был показан in vivo.
Credit:
City of Hope/Mount Sinai Health System | Пресс-релиз
При диабете 1 типа иммунитет человека разрушает производящие инсулин бета-клетки, однако аутопсия показывает, что некоторое число бета-клеток остается у большинства пациентов. Количество бета-клеток снижается и при диабете 2 типа (на 40–60%). Однако существующие препараты для лечения диабета не направлены на регенерацию бета-клеток, несмотря на высокий терапевтический потенциал, а пересадка клеток не доступна большинству пациентов. В новой работе исследователи из США попытались решить эту проблему.
В предыдущих работах ученые уже показали, что малые молекулы — ингибиторы DYRK1A, такие как гармин, самостоятельно и в комбинации с агонистами рецепторов глюкагоноподобного пептида 1 (аГПП-1) активируют пролиферацию бета-клеток человека. Гармин повышает экспрессию маркеров дифференцировки бета-клеток (PDX1, MAFA, MAFB, NKX6.1, PCSK1, GLP1R и SLC2A2) и стимулирует выработку инсулина. Однако остаются сомнения, сработает ли такой подход в клинической практике. Остается проблемой нецелевая активность гармина. Неясно также, повышает ли это вещество выживаемость бета-клеток.
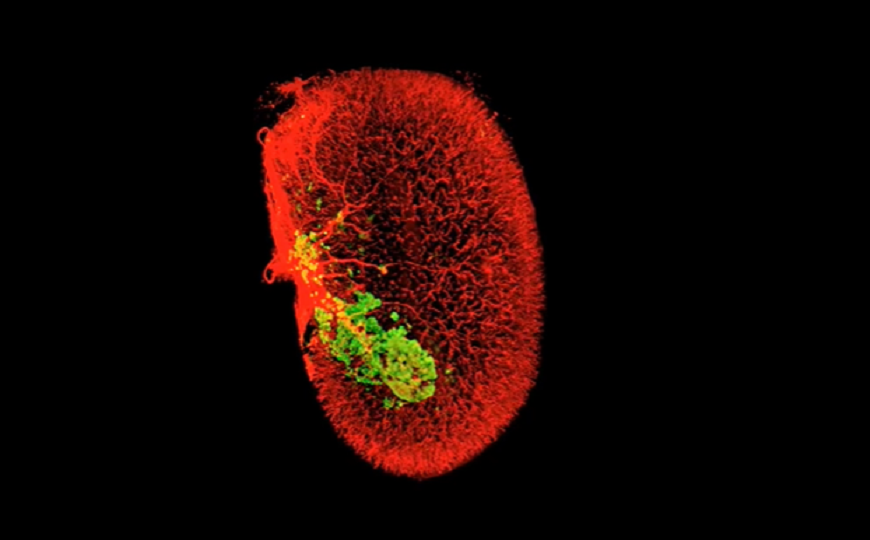
Авторы пересаживали панкреатические островки человека в почечные капсулы мышей без иммунитета, после чего вводили с помощью подкожного осмотического мини-насоса воду, гармин, аГПП-1 (эксендин 4) или гармин + эксендин 4 в течение трех месяцев. Для визуализации почки с бета-клетками использовался метод iDISCO+.
Через четыре недели в первых трех группах количество бета-клеток было примерно одинаковым, но в группе гармин + эксендин 4 их было значительно больше. Клетки быстрее пролиферировали, а умирали с той же скоростью, что и в контрольной группе. Напротив, количество альфа-клеток не изменилось.
Через три месяца средний объем бета-клеток был равен 0,1 мм3 в группе воды и эксендина 4, 0,36 мм3 в группе гармина и 0,75 мм3 в группе гармин + эксендин 4. Размер клеток оставался неизменным. Схожие результаты были получены с более сильнодействующим и селективным ингибитором DYRK1A — 2.2c. Его доза была в три раза ниже, чем гармина.
Спустя месяц после прекращения введения препаратов повышенное количество бета-клеток сохранялось, однако скорость пролиферации снизилась до исходных значений. Гармин и эксендин 4 практически не детектировались в крови.
Такие характеристики донора клеток, как возраст, ИМТ, чистота островков или время культивирования изолированных островков, не влияли на эффективность терапии. Масса мышей значимо не отличалась во всех группах. В группе гармин + эксендин 4 была повышена выработка инсулина. Уровни экспрессии ключевых транскрипционных факторов бета-клеток (PDX1, NKX6.1 и MAFA) были сравнимы во всех четырех группах. Несмотря на повышение массы бета-клеток, мыши, получавшие гармин + эксендин 4, не испытывали гипогликемии.
Ранее было показано, что гармин может активировать пролиферацию альфа-клеток человека и грызунов. Однако в новой работе ни в одной из групп не возросла масса альфа-клеток.
Авторы также исследовали ткани печени, селезенки, кишечника, легких, сердца, почек, поджелудочной и мозга мышей, а также их жировую ткань. Пролиферация собственных бета-клеток мышей выросла, как и ожидалось, но в пролиферация клеток других тканях — нет. Исключение – клетки легких под действием эксендина 4. Поведение мышей оставалось нормальным.
Далее авторы провели опыты на индуцированной стрептозотоцином модели диабета. Мышам без иммунитета с диабетом пересаживали небольшое количество бета-клеток. Их было недостаточно для достижения нормального уровня глюкозы. Однако под действием гармина + эксендина 4 у мышей нормализовалась глюкоза крови, причем это состояние поддерживалось в течение трех месяцев. Уровень инсулина возрастал, но гипогликемия не была зарегистрирована. Объем бета-клеток увеличился примерно на 700% (с 0,08 мм3 до 0,65 мм3) под действием гармина + эксендина 4. Объем альфа-клеток не изменился.
Трансплантация бета-клеток ассоциирована с их массовой гибелью в первые дни после пересадки. Дополнительные эксперименты показали, что терапия способствует выживанию большего числе клеток, а не только увеличивает пролиферацию.
Через неделю терапии авторы секвенировали РНК пересаженных островков. Экспрессия 20 генов была увеличена по крайней мере в 1,5 раза. Эти гены были связаны с секрецией и клеточной адгезией. Выросла экспрессия VGF, PECAM1 и CD93. VGF — известный регулятор работы бета-клеток и их выживания. Нокдаун экспресси VGF блокировал протективный эффект гармина + эксендина 4. То есть VGF может опосредовать эффект терапии. Гармин + эксендин 4 также способствовали образованию сосудов вокруг пересаженных островков.
Недавно исследователи из Маунт-Синай завершили фазу 1 клинических испытаний гармина на здоровых добровольцах с целью определения безопасности и переносимости препарата. Другая группа разработала ингибиторы DYRK1A следующего поколения, сейчас оценивается их безопасность. Авторы работы подчеркивают, что у пациентов с диабетом 1 типа иммунитет продолжит уничтожать новые бета-клетки. Группа из медицинского центра City of Hope планирует протестировать новый метод регенерации бета-клеток в сочетании с иммуномодуляторами.
Источник:
Carolina Rosselot, et al. Harmine and exendin-4 combination therapy safely expands human β cell mass in vivo in a mouse xenograft system // Science Translational Medicine (2024), published 10 July 2024, DOI: 10.1126/scitranslmed.adg3456


 Меню
Меню





 Все темы
Все темы




 0
0








