Опубликованы результаты внутриутробного лечения СМА
В США впервые провели лечение ребенка со спинальной мышечной атрофией первого типа (наиболее тяжелая форма) in utero — до рождения. С 32-й недели беременности до родов мать принимала рисдиплам, модификатор сплайсинга гена SMN2, повышающий продукцию нормального белка. Девочка с восьмого дня жизни стала получать препарат. Сейчас ей 2,5 года, симптомы СМА полностью отсутствуют, однако есть задержка развития, нистагм и легкий правосторонний гемипарез.
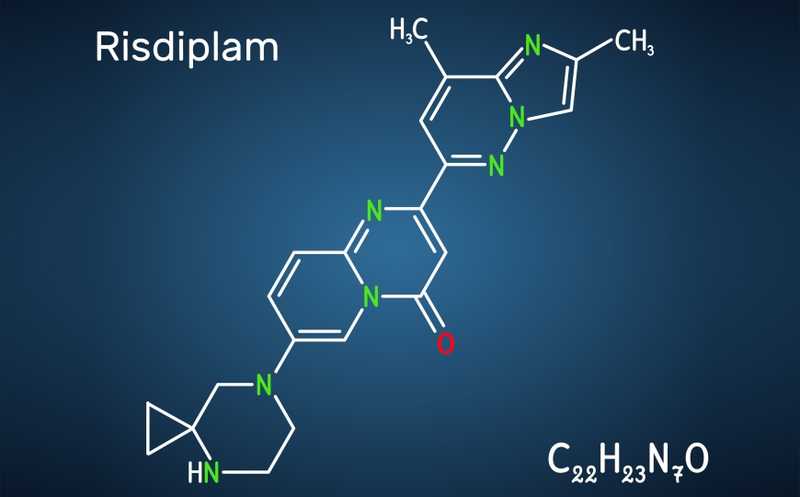
В конце прошлой недели The New England Journal of Medicine опубликовал сообщение о первом случае внутриутробного лечения рисдипламом при спинальной мышечной атрофии (СМА) у плода.
Спинальная мышечная атрофия — наследственное заболевание, для которого характерна мышечная слабость и дегенерация моторных нейронов. Оно вызывается мутациями в гене SMN1, находящемся в хромосоме 5. Делеции или точечные мутации в этом гене приводят к потере функционального белка SMN, необходимого для выживания нейронов. В том же локусе расположен ген SMN2, который почти идентичен SMN1, но из-за отличия в одном нуклеотиде подвергается альтернативному сплайсингу. В результате только 10–20% транскриптов SMN2 кодируют нормальный белок, а остальные — укороченную форму, которая быстро деградирует.
Тем не менее присутствие гена SMN2 уменьшает тяжесть заболевания. У некоторых пациентов число копий SMN2 увеличено, и чем их больше, тем легче клиническая картина. У большинства детей с СМА типа I (наиболее тяжелая форма, которая проявляется в первый месяцы жизни; пациенты, как правило, не могут самостоятельно сидеть, нуждаются в респираторной поддержке и без лечения умирают в раннем детстве) есть только одна или две копии SMN2. Пациенты со СМА типов II и III обычно имеют не менее трех копий SMN2, а пациенты со СМА типа IV (проявляется в 30–40 лет как постепенное ослабевание мышц ног) — не менее четырех копий.
За последние годы FDA одобрила три препарата для лечения СМА: нусинерсен (Спинраза), онасемноген абепарвовек (Золгенсма) и рисдиплам (Эврисди). Золгенсма содержит вирусный вектор, который доставляет в нейроны ген SMN1. Два других препарата нацелены на мРНК гена SMN2: они модифицируют сплайсинг таким образом, что функциональной формы белка становится больше, и это предотвращает гибель нейронов.
Родители девочки, семейная пара из США, в 2015 году потеряли ребенка из-за СМА первого типа. Во время второй беременности они решили сделать генетический тест. Был выполнен амниоцентез — пункция амниотической оболочки и получение образца околоплодных вод. Анализ генома плода показал отсутствие копий гена SMN1 и две копии SMN2. Следовательно, и у второго ребенка была СМА I. На гестационном сроке 25 недель родители спросили врачей, есть ли варианты внутриутробного лечения. Сотрудники Детской исследовательской больницы Св.Иуды (Мемфис, штат Теннесси) предложили такой вариант.
Рисдиплам, в отличие от других препаратов, нужно принимать перорально. Нусинерсен представляет собой модифицированный олигонуклеотид, а активное вещество рисдиплама — это малая молекула, способная проходить через гематоплацентарный барьер. FDA одобрило экспериментальный план лечения именно для этого случая.
Женщина в возрасте 35 лет каждый день принимала по 5 мг рисдиплама перорально, начиная с 32 недели и 5 дней гестационного срока и до родов в 38 недель и 6 дней. Она еженедельно проходила осмотры и УЗИ. Через 8 дней после рождения препарат начали давать новорожденной девочке. На момент публикации статьи ей было 30 месяцев, она все так же получала рисдиплам. Вероятно, терапия будет продолжаться в течение всей жизни. (Портал Endpoints News сообщает, что в возрасте 20 месяцев девочка также получила препарат Золгенсма, однако ни в NEJM, ни в публикации на сайте больницы этой информации нет.)
Исследователи измеряли концентрацию препарата и количество белка SMN в крови матери и ребенка и в амниотической жидкости. При рождении ребенка концентрация рисдиплама составила 33% в амниотической жидкости и 69% в пуповинной крови от концентрации препарата в плазме матери. Концентрация SMN в пуповинной крови достигла 8,4 нг/мл —это существенно больше, чем, например, у младенцев, участвовавших в клиническом исследовании рисдиплама FIREFISH. Уровни нейрофиламентов (структурных белков нейронов, высвобождающихся при их повреждении) в крови ребенка, как при рождении, так и после него, были в пределах нормы — существенно ниже, чем это характерно для детей со СМА при двух копиях SMN2.
На момент рождения девочка выглядела здоровой. Чуть позже обнаружили сердечный шум из-за дефекта межжелудочковой перегородки, но позднее он прошел. У ребенка снижена острота зрения, отмечен фиксационный нистагм (непроизвольные колебательные движения глаз при попытках фиксировать взгляд). Офтальмолог обнаружил двустороннюю гипоплазию зрительного нерва. Также присутствует «легкий гемипарез» (снижение силы мышц) правой половины тела, связанный с гипоплазией левой половины среднего мозга. В приложениях к статья сообщается о «небольшом снижении активности и использования правой руки и ноги» и о том, что девочка научилась самостоятельно сидеть и стоять, но не ползать или ходить. Также у ребенка наблюдается общая задержка развития без регресса. Анализ генома не выявил других генетических нарушений, которые могли бы вызвать подобные симптомы.
Тем не менее никаких признаков СМА (гипотония, слабость, арефлексия, фасцикуляция) не выявлено. Тесты, проводимые каждые полгода, показывают, что развитие периферических нервов и мышц у ребенка соответствует возрасту. Авторы подчеркивают, что хотя результаты единичного случая нельзя обобщать, все же они могут стать началом масштабных испытаний внутриутробного лечения рисдипламом при СМА.
Стоит отметить, что причины нистагма и гемипареза у ребенка пока неясны, и нет оснований связывать их с воздействием рисдиплама. Однако обычно его прием во время беременности не рекомендуется, если же этого требует здоровье матери или беременность наступила неожиданно, то пациентку вносят в реестр, собирающий информацию о влиянии рисдиплама на здоровье беременной и ребенка. Это связано с неоднозначными результатами преклинических испытаний.
В дополнительных материалах к статье авторы упоминают исследования рисдиплама на животных, в которых наблюдались эмбриопатии. Тем не менее максимальные дозы, при которых не отмечены побочные эффекты (no observable adverse event level, NOAEL) были выше, чем разрешенные дозы у взрослых пациентов со СМА, кроме того, исследования на животных проводили на ранних сроках беременности, а не на поздних. Применение рисдиплама в данным случае сочли безопасным как этический комитет больницы, так и производитель препарата Roche.
В информации о безопасности рисдиплама, размещенной на сайте разработчика, компании Genentech, приводятся следующие данные. Когда рисдиплам получали беременные крысы в дозах 1, 3 или 7,5 мг/кг/день в период органогенеза, самая высокая доза снижала массу тела детенышей и увеличивала число случаев структурных изменений плода; это не было связано с токсичностью для матери. Уровень отсутствия неблагоприятного эффектов для эмбриона, следовательно, составил 3 мг/кг/день, при этом концентрация в плазме крови матери была примерно в два раза выше, чем у людей при максимальной рекомендуемой дозе (5 мг в день для пациентов весом более 20 кг). Аналогичный эксперимент на крольчихах (дозы 1, 4 или 12 мг/кг/день) показал, что самая высокая доза ассоциирована с эмбриональной смертностью, порокам развития (гидроцефалия) и структурным изменениям плода. При «безопасной» дозе 4 мг/кг/день уровни рисдиплама в сыворотке крови были примерно в четыре раза выше, чем у людей, принимающих препарат. В других экспериментах на крысах уже при дозе 3 мг/кг/день у потомства женского пола были отмечены задержка полового созревания и нарушения репродуктивной функции.
В то же время терапия рисдипламом, начатая в возрасте нескольких месяцев, не приводит к исчезновению симптомов при СМА I (см. ссылку ниже).
Пять лет испытаний Эврисди против спинальной мышечной атрофии показали эффективность препарата
Источник
Richard S. Finkel, et. al Risdiplam for Prenatal Therapy of Spinal Muscular Atrophy // The New England Journal of Medicine. February 19, 2025. DOI: 10.1056/NEJMc2300802


 Меню
Меню





 Все темы
Все темы




 0
0







