Опыт ксенотрансплантации свиного сердца второму пациенту
В 2023 году генетически модифицированное свиное сердце получил второй пациент, 58-летний Лоуренс Фосетт. Спустя 40 дней после операции, когда появились признаки отторжения, пациент отказался от дальнейшего лечения. В журнале Nature Medicine опубликован подробный отчет о состоянии пациента и вероятных причинах неудачи. Похоже, что отторжение было опосредовано антителами к свиным антигенам, несмотря на то, что изначальный уровень таких антител у пациента был низким. После двух неудач ученые все еще настроены оптимистично.
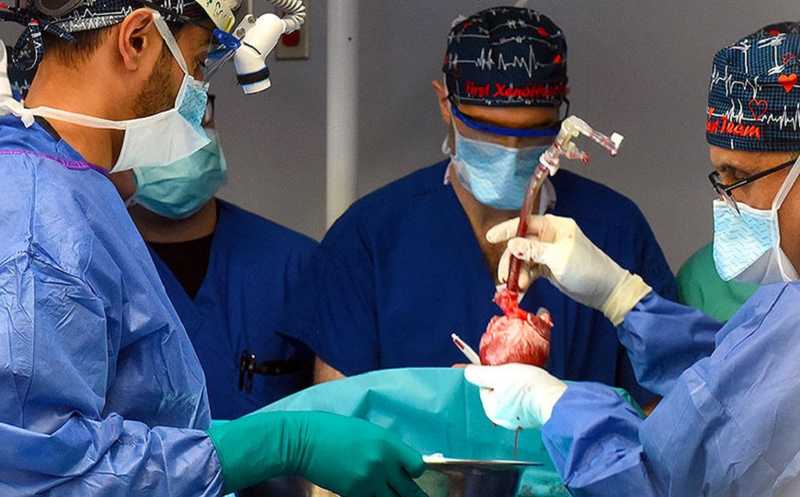
В 2022 году в The New England Journal of Medicine вышла статья о пересадке 57-летнему Дэвиду Беннетту сердца от генетически модифицированной свиньи, у которой было отредактировано 10 генов (подробнее о модификациях на PCR.NEWS). Сердце предоставила компания Revivicor. В первые недели после операции сердце функционировало нормально, однако на 49-й день произошел отказ ксенотрансплантанта, а на 60-й день пациент скончался. Вероятно, причиной смерти стал свиной цитомегаловирус.
В 2023 году свиное сердце от той же компании получил второй пациент, 58-летний Лоуренс Фосетт. Операция была также проведена в Медицинском центре Университета Мэриленда. Когда появились признаки отторжения, пациент решил отказаться от дополнительного лечения. Всего он прожил 40 дней после операции. Отчет об этом опыте был опубликован в начале 2025 года в Nature Medicine.
Вторая ксенотрансплантация сердца была проведена через 21 месяц после первой. Решение о проведение операции было принято после оценки состояния первого пациента. Группа исследователей установила, что генетически модифицированное сердце свиньи является хорошим физиологическим заменителем человеческого сердца и что предыдущий протокол скрининга на цитомегаловирус свиньи был недостаточен для выявления латентного вируса. Также ученые определили, что состояние первого пациента не позволяло использовать иммуносупрессивные и противовирусные схемы, которые были отработали в опытах на обезьянах.
Лоуренсу Фосетту было отказано в традиционной трансплантации из-за заболевания периферических сосудов и осложнений, связанных с внутренним кровотечением. Уровень антипорциновых антител в сыворотке пациента был признан приемлемо низким. Клетки свиньи с десятью отредактированными генами не вызывали цитотоксической реакции. Пациенту было введено анти-CD40L моноклональное антитело Тегопрубарт (Eledon Pharmaceuticals) перед операцией. По оценкам врачей, состояние второго пациента перед операцией было лучше, чем первого.
Донорское свиное сердце 18-месячной свиньи весило 273 г. Оно было подключено к системе перфузии XVIVO в течение 49 минут. После имплантации и реперфузии сердце функционировало хорошо, с синусовым ритмом 40 ударов в минуту, что потребовало увеличения ритма до 80-90 ударов в минуту, но без инотропной поддержки.
Послеоперационная рентгенограмма продемонстрировала улучшение состояния легких. Эндотрахеальная трубка была удалена через день после операции. Короткий период гемодинамической нестабильности на второй день после операции разрешился с помощью инотропной поддержки, а также увеличения скорости ритма до 120 ударов в минуту. На четвертый день у пациента возникло внезапное медиастинальное кровотечение, которое потребовало переливания крови. После операции пациент был реэкстубирован, но испытывал трудности с выводом легочных выделений. На седьмой день операции у него произошла остановка дыхания и сердцебиения. Реинтубация и быстрое восстановление кровообращения в течение четырех минут позволили предотвратить появление неврологических последствий. Была проведена чрескожная трахеостомия. Пациент мог вставать с посторонней помощью.
Вестерн-блот и ПЦР-анализ не выявили цитомегаловирус свиньи ни в тканях пациента, ни в тканях свиньи. Анализ внеклеточной ДНК плазмы крови дал положительные сигналы для бактерий Legionella, Staphylococcus epidermidis и желудочно-кишечных анаэробов. Ни один из этих микроорганизмов не вырос в культуре, однако пациенту была назначена таргетная терапия. Единственным вирусом, выявленным в ПЦР кала и дыхательных путей, был саповирус (однако клиническая значимость данного результата была неясной).
На 29-й день после операции было отмечено ухудшение самочувствия пациента. Возникла острая гемодинамическая декомпенсация, потребовавшая проведения жидкостной реанимации (восполнения жидкостей) и повышения титра вазопрессоров. В связи с подозрением на сепсис была назначена расширенная антибиотикотерапия. На 30-й день пациенту была проведена срочная катетеризация сердца. Врачи выявили недостаточность работы правого предсердия и правого желудочка. На 31-й день пациент был переведен на экстракорпоральную мембранную оксигенацию (ЭКМО). На 35-й день подтвердились результаты иммуногистохимии второй биопсии, свидетельствующие о наличии опосредованного антителами отторжения органа. К 40-му дню, когда систолическая и диастолическая функции сердца на ЭКМО не улучшались, пациент отказался от поддерживающей терапии.
На вскрытии было обнаружено значительное утолщение ксенотрансплантата (вес 480 г. по сравнению с 273 г. до операции). Гистологически наблюдалось обширное повреждение и потеря эндотелия сердца с вторичной ишемией и некрозом миоцитов. Были обнаружены признаки инфаркта и эрозии. Экспрессия трансгенов была подтверждена с помощью вестерн-блота до, после операции и при вскрытии.
По мнению авторов, необходимо продолжать исследования для преодоления таких проблем, как отторжение, опосредованное антителами. Несмотря на то, что у пациента был низкий уровень антител к свиным антигенам, команда трансплантологов обнаружила резкое увеличение количества этих антител, что вызвало повреждение сердца и в конечном итоге привело к отказу трансплантата. При дальнейших трансплантациях может потребоваться более агрессивное подавление таких антител. Эти исследования позволили уточнить влияние других иммуноопосредованных механизмов на отказ трансплантата.
«Несмотря на неудачи, связанные с иммунологическим отторжением через несколько недель, ксенотрансплантация и донорство от живых родственников остаются наиболее жизнеспособными вариантами на пути к устойчивому обеспечению органами стареющего населения. Мы, безусловно, сталкивались с похожими проблемами на заре трансплантации солидных органов», — говорит Марк Т. Глэдвин, вице-президент по медицинским вопросам Университета Мэриленда в Балтиморе.
Человеку впервые трансплантировали сердце генно-модифицированной свиньи
Источники:
Griffith B.P., et al. Transplantation of a genetically modified porcine heart into a live human // Nature Medicine (2025), Published Online 8 January, 2025. DOI: 10.1038/s41591-024-03429-1
Цитата по пресс-релизу.


 Меню
Меню





 Все темы
Все темы




 0
0







