Противоопухолевый препарат помог получить клетки, секретирующие инсулин, из стволовых
AT7867 — препарат, подавляющий рост опухолей. Канадские ученые использовали это соединение для дифференцировки плюрипотентных стволовых клеток в панкреатические клетки-предшественники. Трансплантация полученных таким методом клеток снижала уровень сахара в мышиной модели диабета эффективнее, чем пересадка клеток, получаемых по стандартному протоколу.
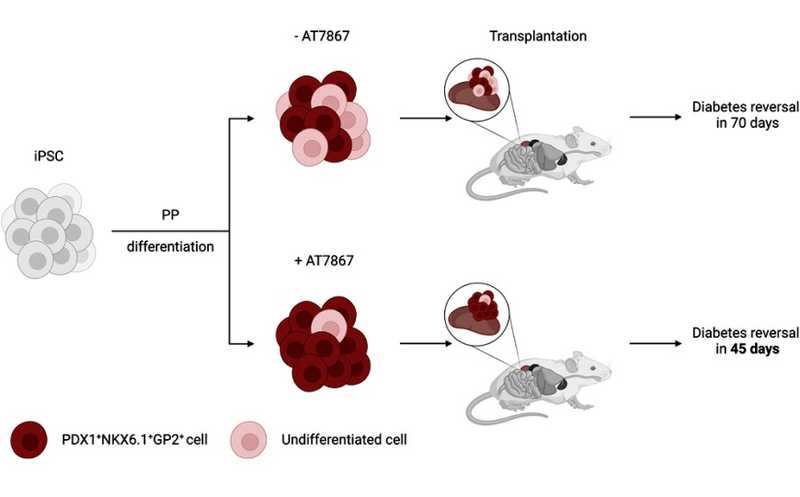
Противоопухолевый препарат AT7867 способствует дифференцировке плюрипотентных стволовых клеток в панкреатические клетки-предшественники. Такой подход позволяет получить клетки, которые при пересадке эффективнее нормализуют уровень глюкозы у мышей с диабетом, чем полученные по стандартному протоколу клетки.
Credit:
Stem Sell Reports (2023). DOI:
10.1016/j.stemcr.2023.10.005 |
CC BY-NC-ND
В журнале Stem Sell Reports опубликовали исследование панкреатических клеток-предшественников, полученных из стволовых клеток по модифицированному протоколу. Отличие предложенного метода заключалось в обработке клеток противоопухолевым препаратом AT7867. Клетки, полученные по такой методике, более активно экспрессировали гены, связанные с дифференцировкой стволовых клеток в панкреатические клетки-предшественники, а при трансплантации эффективно снижали уровень сахара у мышей с диабетом.
Авторы исследования дифференцировали плюрипотентные стволовые клетки в соответствии с опубликованным ранее протоколом, но на одной из стадий культивирования вносили в среду препарат AT7867. В результате 90,8% клеток начинали совместно экспрессировать PDX1 и NKX6.1, а 90% клеток — PDX1 и GP2 (маркеры предшественников панкреатических клеток), в то время как среди контрольных клеток, полученных по стандартному протоколу, 50,9% совместно экспрессировали PDX1 и NKX6.1, и 39,2% клеток — PDX1 и GP2. Количество клеток и общее количество белка в опытной и контрольной культурах не различались.
Клетки, обработанные AT7867, существенно отличались и на транскриптомном уровне. Добавление этого соединения приводило к значительному усилению регуляции факторов транскрипции панкреатических клеток-предшественников (GP2, NKX6.1, ONECUT1 и PDX1), а также факторов транскрипции панкреатических эндокринных клеток (ARX, HNF4A, NEUROD1, NEUROG3, NKX2.2 и PAX4). В то же время экспрессия генов плюрипотентности ALPL и MYC и мезенхимального маркера TBX2 снижалась в результате обработки AT7867.
Ученые сравнили эффективность модифицированного ими метода дифференцировки клеток с еще одним методом, опубликованным ранее в Nature Biotechnology. Оба подхода успешно позволяли получить PDX1+NKX6.1+ и PDX1+GP2+ клети, но количество NKX6.1+CHGA+ клеток значительно различалось: коэкспрессия этих молекул была обнаружена у 2,7% клеток, обработанных AT7867, и у 92,2% клеток, дифференцированных упомянутым выше методом. Ранее было показано, что преждевременная эндокринная стимуляция (CHGA) в сочетании с PDX1 и NKX6.1 приводит к отходу от β-клеточной линии и образованию полигормональных клеток.
Также значительные различия выявил транскриптомный анализ. Дифференцировка клеток в среде с AT7867 повышала экспрессию генов, связанных с дифференцировкой панкреатических клеток предшественников и детерминацией линии эндокринных панкреатических клеток. Однако экспрессия генов MAFB, NEUROD1, NEUROG3, NKX2.2, PAX4 и PAX6 в этих клетках была ниже. Снижалась и экспрессия генов, связанных с плюрипотентностью клеток.
Для изучения полученных клеток in vivo авторы работы имплантировали кластеры клеток под почечную капсулу мышам с диабетом. Трижды в неделю ученые измеряли уровень глюкозы в крови животных. У контрольных мышей с диабетом на протяжении всего эксперимента сохранялся повышенный уровень глюкозы. У животных, которым трансплантировали контрольные панкреатические клетки-предшественники, в течение 70 дней уровень глюкозы нормализовался, в то время как трансплантация клеток, обработанных AT7867, давала такой же результат через 45 дней.
Показатели внутрибрюшинного теста на глюкозотолерантность, проведенного через 8 недель после трансплантации, также различались у контрольных и опытных животных. У мышей, которым трансплантировали клетки, обработанные AT7867, глюкозотолерантность была ближе к уровню здоровых животных, чем тех, которым трансплантировали контрольные панкреатические клетки-предшественники. Также у мышей, получавших обработанные AT7867 клетки, через 60 минут после введения глюкозы вырабатывался С-пептид (показатель, характеризующий выработку инсулина). У животных, которым пересаживали контрольные клетки, через 8 недель после операции С-пептид не вырабатывался, но спустя 12 недель во всех группах профили глюкозотолерантного теста и уровни С-пептида были аналогичны с показателями контрольных животных.
Наконец, патологоанатомическое исследование показало, что клетки, обработанные AT7867, образовывали меньшие по размеру трансплантаты. Как контрольные, так и обработанные AT7867 клетки были способны созревать в моногормональные клетки, секретирующие инсулин или глюкагон. Кроме того, у животных, которым трансплантировали клетки, обработанные AT7867, обнаруживалось больше зрелых MAFA+ β-клеток.
Таким образом, модифицированный протокол дифференцировки плюрипотентных стволовых клеток в панкреатические клетки-предшественники способствовал более эффективному снижению уровня сахара у мышей при меньшем размере трансплантата, чем разработанные ранее методы.
Подкожная трансплантация островков Лангерганса позволяет контролировать диабет 1 типа


 Меню
Меню





 Все темы
Все темы




 0
0