Размер головного мозга человека зависит от активности Wnt в эмбриогенезе
Микро- и макроцефалия — два зеркально противоположных фенотипа мозга, характеризующиеся его аномальными размерами и когнитивными нарушениями. Международный коллектив ученых показал, что за объем мозга отвечает сигнальный путь Wnt — мутации в белке ZNRF3, обеспечивающем отрицательную обратную связь в этом пути, меняют активность сигналинга. Это приводит к наследственной микроцефалии при недостатке сигнала и макроцефалии при его избытке.
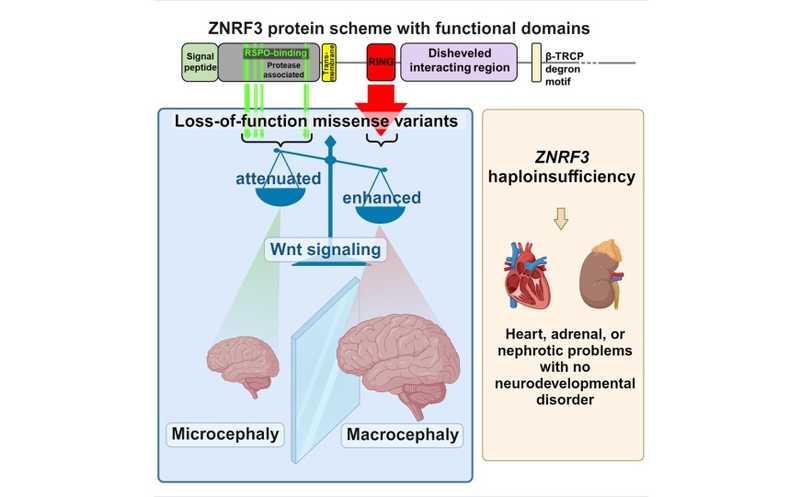
Перекос в активности сигнального пути Wnt, вызванный мутациями в ZNRF3, приводит к аномалиям развития головного мозга — микроцефалии или макроцефалии.
Credit:
The American Journal of Human Genetics. DOI:
10.1016/j.ajhg.2024.07.016 |
CC BY
Развитие головного мозга, как и многие другие этапы формирования организма, контролируется сигнальным путем Wnt. Изменение уровня его активности в эмбриогенезе может привести как к дефициту нервных клеток и микроцефалии, так и к их избытку и макроцефалии. Оба этих состояния характеризуются задержкой умственного развития. Исследование международного коллектива ученых показало, что важную роль в них играет белок ZNRF3, который обеспечивает отрицательную обратную связь в каноническом Wnt-сигналинге.
Сигнальный путь Wnt регулирует эмбриогенез, пролиферацию и дифференцировку клеток. Wnt связывается со своим рецептором Frizzled (FZD) и корецептором LRP5/6. В каноническом пути передачи сигнала учувствует β-катенин (сигнальный путь Wnt/β-катенин). Данный сигнальный путь отвечает за пролиферацию клеток, в том числе нейрогенез. Соматические мутации в генах-участниках сигнального пути Wnt/β-катенин связаны с онкологическими заболеваниями, а зародышевые — с патологиями развития. Одним из генов, который экспрессируется из-за активации канонического Wnt-пути, является Znrf3. Белок ZNRF3 — трансмембранная убиквитинлигаза, которая инактивирует рецепторный комплекс FZD и ослабляет сигнал Wnt. Иными словами, ZNRF3 обеспечивает отрицательную обратную связь канонического пути. Также он способен связывать белки R-спондины (RSPO), которые стимулируют интернализацию ZNRF3 и тем самым усиливают сигналинг Wnt.Как уже говорилось выше, уровнем активности Wnt-пути строго регулируется кортикогенез. На его ранних стадиях Wnt активирует деление апикальных клеток-предшественников (APC). ZNRF3 регулирует этот процесс по принципу отрицательной обратной связи. Когда APC становится достаточно, Wnt-сигналинг также ослабляется другим белком — WDFY3, — что обеспечивает дифференцировку нервных клеток.
У мышей полный нокаут Znrf3 приводит к перинатальной гибели, а гетерозиготные особи имеют аномалии гонад. Известно, что у людей соматические мутации в Znrf3 часто ассоциированы с раком, а зародышевые — с пороками развития. Однако роль мутаций Znrf3 в нарушениях развития нервной системы не исследовалась. Авторы работы проанализировали данные 12 носителей различных мутаций Znrf3 в гетерозиготе. Информация об этих пациентах и последовательности гена были взяты из различных баз данных, например, из работ по изучению генетики микроцефалии. Ученые провели компьютерное моделирование взаимодействий доменов ZNRF3 с белками-партнерами на основании уже известных моделей ортологичных генов. Кроме того, влияние мутантных форм на активность сигнального пути Wnt/β-катенин проверили на коммерческой линии клеток SuperTopFlash HEK293, специально предназначенной для изучения компонентов Wnt-пути.
4 из 12 пациентов имели сильно усеченные варианты ZNRF3 или несли в этом гене большие делеции. По сути, они были гемизиготами по Znrf3, и, не обладая нарушениями нервной системы, имели различные пороки развития. У остальных 8 человек в этом гене имелись миссенс-мутации. Один из них имел мутацию в RSPO-связывающем домене ZNRF3 и страдал микроцефалией, ещё шестеро несли мутации, нарушающие функцию RING-домена, и страдали макроцефалией (оставшийся восьмой участник подвергался воздействию высоких доз опиоидов в ходе эмбриогенеза и тоже страдал микроцефалией).
Эксперименты по экспрессии мутантных форм ZNRF3 в клетках HEK293 выявили доминантно-негативное наследование мутаций в домене RING. ZNRF3 функционирует в виде димера, и взаимодействие нормального и мутантного белков, вероятно, приводит к нарушению убиквитинлигазной активности ZNRF3.
Таким образом, мутации в RSPO-связывающем домене ZNRF3, препятствующие взаимодействию RSPO с ZNRF3, снижают активность Wnt/β-катенинового сигнального пути, что приводит к микроцефалии. Нарушение взаимодействия с RSPO ослабляет интернализацию ZNRF3- LGR комплексов и способствует накоплению в мембране ZNRF3. Он, в свою очередь, убиквитинирует рецептор FZD, что приводит к интернализации комплексов FZD-LRP5/6 и снижению активности сигнального пути.
В то же время мутации в RING-домене ZNRF3, приводящие к нарушению убиквитинирования FZD и, следовательно, препятствующие интернализации комплексов FZD-LRP5/6, разрушают отрицательную обратную связь Wnt-сигналинга и увеличивают его активность, что приводит к развитию макроцефалии.
Полученные результаты объясняют связь между ZNRF3 и двумя зеркально противоположными фенотипами мозга — микро- и макроцефалией. Они подчеркивают роль сигнального пути Wnt/β-катенин в формировании правильного размера мозга человека в процессе нейрогенеза.
Источник
Paranchai Boonsawat, et al. Deleterious ZNRF3 germline variants cause neurodevelopmental disorders with mirror brain phenotypes via domain-specific effects on Wnt/β-catenin signaling. // The American Journal of Human Genetics, Volume 111, Issue 9, 2024. DOI: 10.1016/j.ajhg.2024.07.016


 Меню
Меню





 Все темы
Все темы




 0
0








