Самки утконосов компенсируют двойную дозу генов Х-хромосом не так, как плацентарные млекопитающие
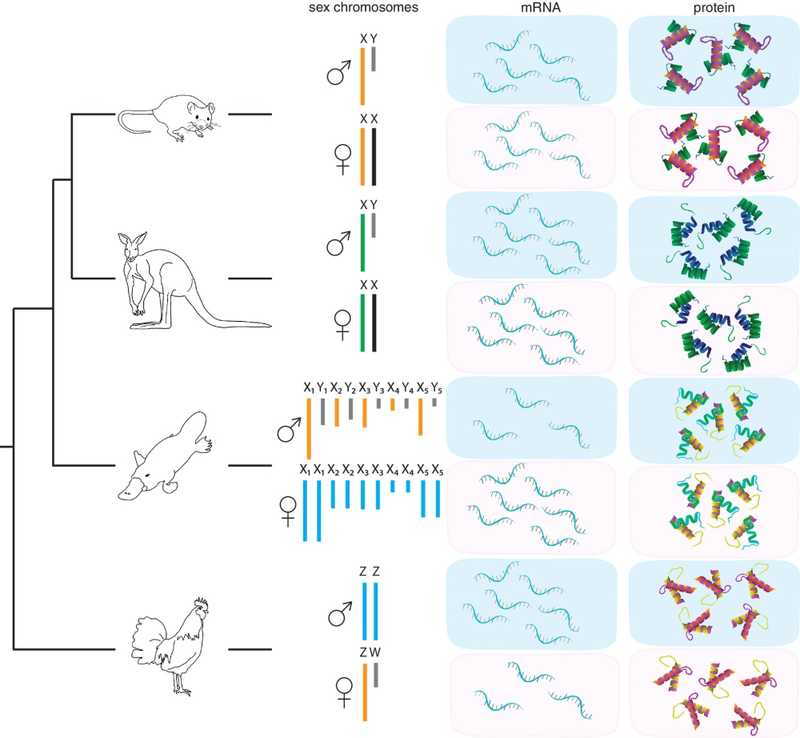
У многих животных один из полов является гетерогаметным (имеет две разные половые хромосомы), а другой — гомогаметным (имеет одинаковые половые хромосомы). У гомогаметного пола вдвое больше генов половой хромосомы, чем у гетерогаметного. В клетках самок плацентарных млекопитающих одна из Х-хромосом инактивирована. Оказывается, у утконосов и птиц этого не происходит, а регуляция осуществляется на уровне трансляции белков.

У самок большинства млекопитающих две Х-хромосомы, у самцов — Х- и X-хромосомы. Чтобы не было избыточной продукции генов, расположенных на Х-хромосоме, одна из Х-хромосом в клетках самок инактивирована и представляет собой тельце Барра. Это верно для человека, мыши и даже мамонта. Международная группа под руководством исследователей из Университета Нового Южного Уэльса в Сиднее установила, что у птиц и однопроходных млекопитающих компенсация дозы генов половой хромосомы происходит иначе. Они исследовали кур и утконосов.
У кур, как и у других птиц, половые хромосомы обозначаются ZW, и гетерохромосомным полом являются самки, а не самцы: у самцов две Z-хромосомы, у самок — Z и W-хромосомы. Еще интереснее система определения пола у утконосов: пять пар Х-хромосом у самок, пять Х-хромосом и пять Y-хромосом у самцов. В мейозе мужских клеток десять половых хромосом образуют цепь, удерживаемую вместе рекомбинацией в девяти псевдоаутосомных регионах (PAR), общих для X- и Y-хромосом. Половые хромосомы утконоса не имеют гомологии с половыми хромосомами плацентарных и сумчатых млекопитающих, но имеют значительную гомологию с Z-хромосомой курицы.
У человека на Х-хромосоме находится более 859 генов, у представителя сумчатых (опоссума) — около 500. На куриной Z-хромосоме расположено около 865 генов. У утконоса примерно 9,23% генома присутствуют в одной дозе у самцов и в двух дозах у самок. Очевидно, что те или иные компенсационные механизмы необходимы всем этим группам животных.
У самцов и самок плацентарных и сумчатых млекопитающих количества мРНК генов Х-хромосомы сбалансированы, так как гены инактивированной хромосомы не экспрессируется. Для Х-хромосомы человека это продемонстрировала еще в 1986 году профессор Дженни Грейвс с кафедры окружающей среды и генетики Университета Ла Троба, один из соавторов нового исследования.
Однако у самцов и самок птиц и однопроходных наблюдается дисбаланс мРНК генов половой хромосомы; дозы мРНК могут различаться, иногда очень сильно. Считалось, что у птиц дозовая компенсация не происходит или ограничивается генами, чувствительными к дозировке. Альтернативная возможность — посттранскрипционная корректировка, на уровне белка — рассматривалась, но данных было недостаточно.
Авторы исследования, результаты которого опубликованы в PNAS, сначала измерили количества кодируемых Х-хромосомой мРНК и белков у мышей и опоссумов. Соотношения мРНК и белков у самцов и самок были близки к 1:1. Но когда авторы рассчитали соответствующие соотношения мРНК в фибробластах, сердце и печени утконоса, гены, специфичные для Х-хромосом, показали совершенно иной результат. У самцов этих мРНК было существенно меньше, медианное отношение M:F во всех тканях составило 0,67, то есть оказалось промежуточным между полным отсутствием компенсации (0,5) и полной компенсацией (1). При этом соотношения белков в сердце и фибробластах были полностью скомпенсированы, а в печени приближались к 1:1.
Эти наблюдения предполагают, что у самцов и самок утконоса компенсация дозировки генов, специфичных для X-хромосомы, достигается частичной транскрипционной регуляцией, которая дополняется посттранскрипционной регуляцией. Баланс между транскрипционным и посттранскрипционным контролем может различаться в разных тканях и между разными X-хромосомами.
Затем авторы исследовали транскриптомы и протеомы печени цыплят обоего пола, и также увидели сильное увеличение количества транскриптов Z-хромосомы у петухов по сравнению с курами. Однако медианное соотношение белков в обеих тканях приближалось к 1:1.
Инактивация Х-хромосомы у плацентарных млекопитающих происходит за счет метилирования ДНК и модификации гистонов. У самок утконоса ранее было обнаружено лишь незначительное увеличение метилирования на хромосомах Х1 и Х2. Авторы провели секвенирование иммунопреципитации хроматина (ChIP-seq) из фибробластов утконоса, чтобы обнаружить модификации гистонов H3 и H4, связанные с активной транскрипцией (H3K27ac, H3K4me1, H3K4me3 и H4K20me1). У обоих полов было обнаружено меньше пиков ChIP в X-специфичных регионах, чем на аутосомах и в регионах PAR Х- и Y-хромосом, для всех четырех модификаций гистонов, за исключением H3K4me1. Для этой модификации у самцов наблюдалось 20%-ное увеличение пиковой плотности на X-хромосомах по сравнению с аутосомами, а у самок — напротив, 83%-ное снижение. Это различие может быть причиной более активной транскрипции генов Х-хромосомы у самцов, что обеспечивает частичную компенсацию.
Однако полная компенсация у кур и утконосов происходит только на уровне белков. Регулировка доз может осуществляться за счет различной активности трансляции или скоростей распада транскриптов у самцов и у самок.
 Credit: PNAS, 2024. DOI:
10.1073/pnas.2322360121 | CC BY-NC-ND 4.0
Credit: PNAS, 2024. DOI:
10.1073/pnas.2322360121 | CC BY-NC-ND 4.0
Очевидно, что посттранскрипционная регуляция должна быть геноспецифичной, поскольку различные гены по-разному регулируются на транскрипционном уровне. Возможно, мРНК, происходящие из половых хромосом, несут эпигенетические метки или регулируются с помощью микроРНК.
Авторы задаются вопросом, является ли эта комбинация транскрипционного и посттранскрипционного контроля предковой по отношению к дозовой компенсации у всех позвоночных или, по крайней мере, у амниот (пресмыкающихся, птиц и млекопитающих). Было бы интересно сравнить дозовую компенсацию у рептилий, амфибий и рыб, отмечают они.
Xist, инактиватор Х-хромосомы в женских клетках, способствует развитию аутоиммунных заболеваний
Источник
Nicholas C. Lister, et al. Incomplete transcriptional dosage compensation of chicken and platypus sex chromosomes is balanced by post-transcriptional compensation // Proceedings of the National Academy of Sciences (PNAS), July 29, 2024. 121 (32) e2322360121. DOI: 10.1073/pnas.2322360121


 Меню
Меню





 Все темы
Все темы




 0
0








