Сердечная недостаточность влияет на эпигеном гемопоэтических стволовых клеток
Японские и канадские ученые установили, что сердечная недостаточность влияет на гемопоэтические стволовые клетки на эпигенетическом уровне. Эти изменения, в свою очередь, меняют судьбу производимых макрофагов — они начинают экспрессировать маркеры воспаления и активнее заселяют сердце, что повышает риск возникновения сердечно-сосудистых осложнений.
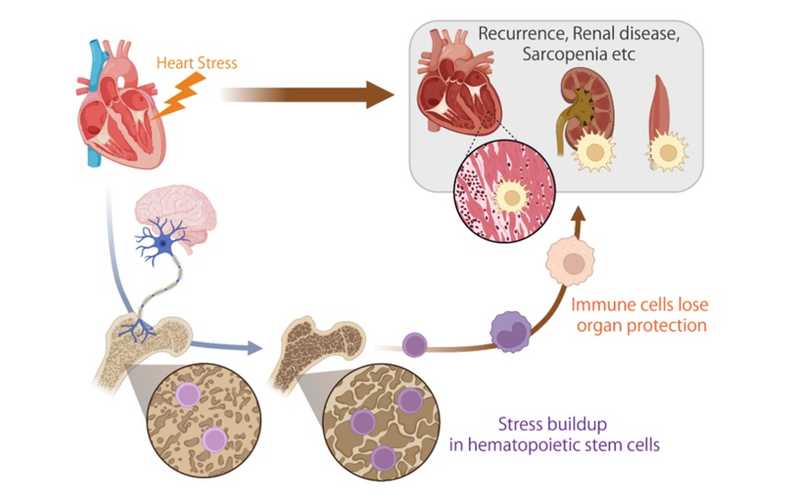
При сердечной недостаточности стрессовые сигналы передаются гемопоэтическим стволовым клеткам (ГСК), накапливаясь в виде эпигенетической памяти о стрессе. Такие ГСК производят иммунные клетки с ограниченными защитными способностями, и их накопление может в дальнейшем повреждать сердце, почки и скелетные мышцы.
Credit:
2024 Y. Nakayama, K. Fujiu, T. Oshima et al./ Science Immunology |
пресс-релиз
Несмотря на достижения медицины, смертность от сердечной недостаточности остается высокой, и существует острая потребность в новых терапевтических мишенях. Авторы статьи в Science Immunology показали на мышах, что сердечная недостаточность изменяет эпигеном гемопоэтических стволовых клеток (ГСК), стимулируя заселение миокарда макрофагами с провоспалительным фенотипом.
Недавние исследования показали, что последствия иммунной реакции затрагивают гемопоэтические стволовые и прогениторные клетки. Изменения врожденной иммунной памяти, в свою очередь, могут модулировать судьбу производимых моноцитов и макрофагов. Ученые задались вопросом, повлияет ли иммунная память ГСК, индуцированная сердечной недостаточностью, на патогенез сердца. Они вызвали сердечную недостаточность у мышей с помощью поперечного сужения аорты (transverse aortic constriction). Через четыре недели костный мозг этих животных пересадили молодым здоровым мышам, которым предварительно удалили собственный костный мозг с помощью облучения. Через четыре месяца после трансплантации у мышей, получавших костный мозг от животных с сердечной недостаточностью, наблюдалось снижение сердечной функции и усиление фиброза; через шесть месяцев эти изменения становились еще более выраженными.
Затем исследователи установили, что ГСК животных с сердечной недостаточностью предпочтительно дифференцируются в CCR2+, чем в тканерезидентные CCR2– макрофаги. Чтобы это выяснить, ученые подсаживали облученным мышам ГСК одновременно опытных и контрольных животных (опытные и контрольные мыши несли разные варианты CD45). Проточная цитометрия показала, что при сердечной недостаточности соотношение субпопуляций макрофагов меняется — ГСК начинают генерировать больше CCR2+ макрофагов. Авторы предположили, что в таком случае происходящие от ГСК клетки имеют больший потенциал для заселения миокарда.
Секвенирование РНК резидентных макрофагов сердца показало, что при сердечной недостаточности в них меняется генная сигнатура: экспрессия собственно генов сердечных макрофагов снижается, а вот уровень генов моноцитов, напротив, возрастает. Кроме того, увеличивается экспрессия генов, ассоциированных с воспалительными процессами.
Изменения, вызванные сердечной недостаточностью, также затрагивали другие органы — у мышей возрастала уязвимость почек и скелетных мышц к повреждениям, причем это было ассоциировано с накоплением провоспалительных макрофагов.
Далее авторы статьи подробнее охарактеризовали механизмы, которые могут влиять на ГСК при сердечной недостаточности. Анализ доступности хроматина методом ATAC-seq показал, что сердечная недостаточность повлияла на эпигеном ГСК: исходное разнообразие гемопоэтических стволовых клеток сокращалось у мышей с сердечной недостаточностью по сравнению с контрольными животными. Поиск мотивов связывания белков выявил, что при сердечной недостаточности меняется доступность участков связывания транскрипционных факторов, участвующих в регуляции кроветворения, в том числе GATA3 и Smad3. Анализ обогащения по функциональной принадлежности (GSEA) выявил также ослабление TGF-β-сигналинга.
Опираясь на эти данные, авторы дополнительно исследовали работу TGF-β-пути в контексте сердечной недостаточности. Концентрация активного TGF-β значимо снижалась через неделю после индукции сердечной недостаточности, однако затем постепенно восстанавливалась. Это обеспечивало пролиферацию ГСК, которая подавляется TGF-β — его введение мышам снижало избыточную пролиферацию ГСК. Интересно, что количество пролиферирующих ГСК постепенно увеличивалось в течение четырех недель, тогда как отклонения TGF-β от нормального уровня переставали быть значимыми уже на второй неделе. Обратив на это внимание, исследователи занялись поиском других источников сигнала и обнаружили, что им могут служить симпатические нервы. Это дополнительно подтвердилось в системе парабиоза — когда к кровеносной системе мыши с сердечной недостаточностью «подключали» здоровую мышь, у последней снижалась пролиферация ГСК. Такой результат исключает участие кровотока в передаче сигналов TGF-β в данном случае.
Чтобы проверить, влияет ли ингибирование TGF-β в ГСК на сердечную функцию, ученые пересадили ГСК от мышей-доноров, которым в течение двух недель вводили ингибитор TGF-β. Через полгода после трансплантации у мышей-реципиентов развивались нарушения функции сердца, в отличие от контрольных животных, ГСК которым пересаживали от доноров, получавших вместо ингибитора только растворитель.
Исследователи также сравнили данные секвенирования РНК клеток костного мозга мышей, получавших ингибитор TGF-β, и мышей с сердечной недостаточностью. Оба воздействия оказывали похожее влияние на транскриптом ГСК, поэтому авторы работы предположили, что TGF-β-сигналинг по крайней мере частично объясняет эффект сердечной недостаточности, который та оказывает на ГСК.
Таким образом, гемопоэтические стволовые клетки реагируют на сердечную недостаточность изменением на эпигеномном уровне, которое, в свою очередь, усиливает формирование связанных с воспалением популяций макрофагов.
Макрофаги способствуют ухудшению состояния у пациентов с мерцательной аритмией
Источник
Yukiteru Nakayama et al. Heart failure promotes multimorbidity through innate immune memory. // Science Immunology (2024). DOI: 10.1126/sciimmunol.ade3814


 Меню
Меню





 Все темы
Все темы




 0
0








