США начинают клинические испытания ремдесивира против нового коронавируса
Национальные институты здравоохранения США (NIH) начали клиническое испытание ремдесивира для лечения COVID-19. В нем, вероятно, примут участие американцы, инфицированные на круизном судне «Diamond Princess».
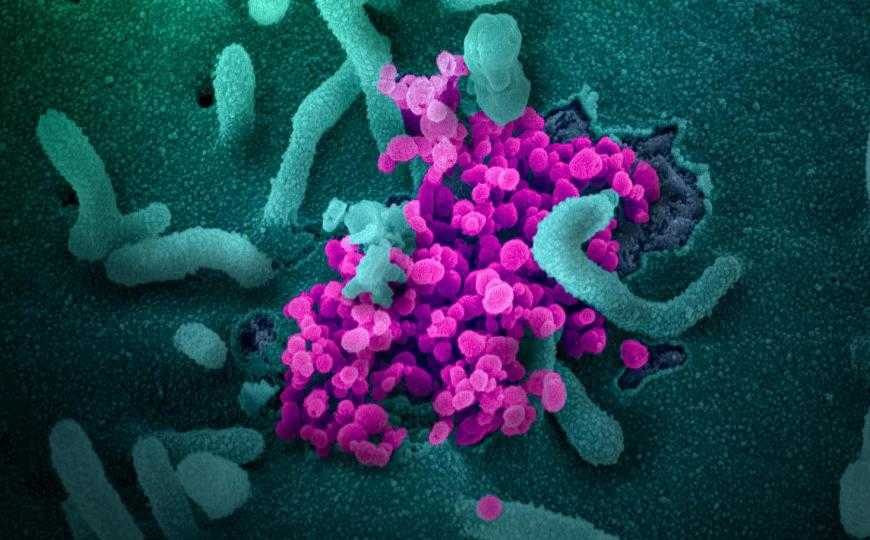
Новый коронавирус SARS-CoV-2 (круглые объекты малинового цвета на поверхности клетки). Сканирующая электронная микроскопия.
Credit: NIAID-RML
Рандомизированное контролируемое клиническое исследование для оценки безопасности и эффективности ремдесивира при лечении взрослых, госпитализированных с диагнозом «коронавирусная болезнь 2019» (COVID-19) началось в Медицинском центре Университета Небраски (UNMC) в Омахе. Спонсор исследования — Национальный институт аллергии и инфекционных заболеваний (NIAID) , входящий в состав Национального институтов здравоохранения. Это первое клиническое исследование в США, в котором оценивается лекарство против COVID-19.
Пока ни одно лекарственное средство не одобрено для лечения COVID-19 Управлением по контролю пищевых продуктов и медикаментов США (FDA). Согласно данным Центров по контролю и профилактике заболеваний (CDC), 24 февраля в США было зарегистрировано 14 подтвержденных случаев COVID-19, из них 12 связаны с путешествиями и два — с местной передачей инфекции, плюс 39 случаев среди лиц, репатриированных в Соединенные Штаты (трое из Уханя, остальные с круизного судна «Diamond Princess», которое пришвартовалось в Иокогаме). По состоянию на 26 февраля зарегистрировано 81 005 случаев коронавирусной инфекции в мире, 2 762 летальных исхода, 20 116 человек выздоровели. В России по-прежнему сообщают о двух случаях, не считая инфицированных на «Diamond Princess».
Первым участником испытания пожелал стать американец с «Diamond Princess». Тринадцать пассажиров этого судна Госдепартамент США перевез 17 февраля в Национальный карантинный центр, расположенный в Центре обучения, моделирования и карантина в Медицинском кампусе UNMC/Небраска. С тех пор CDC сообщил, что у 11 из них подтверждена инфекция SARS-CoV-2. Вероятно, кто-то из них примет участие в КИ. Исследование может быть адаптировано для оценки дополнительных методов лечения и для регистрации участников в других местах США и по всему миру, сообщается в пресс-релизе NIH. Предполагаемое количество участников— 394 человека (ClinicalTrials.gov, NCT04280705).
Ремдесивир, разработанный Gilead Sciences Inc., —антивирусный препарат широкого спектра действия. Его клинические испытания начаты в Китае. NIAID разработал текущее исследование с учетом дизайна этих испытаний и в соответствии с проведенными ВОЗ консультациями. Ранее ремдесивир был протестирован на людях с лихорадкой Эбола, а также хорошо показал себя при лечении приматов, инфицированных вирусом ближневосточного респираторного синдрома (MERS); статья недавно опубликована в PNAS. Препарат показал многообещающие результаты и при атипичной пневмонии (SARS).
«Нам срочно необходимо безопасное и эффективное лечение COVID-19. Несмотря на то, что ремдесивир назначали некоторым пациентам с COVID-19, у нас нет достоверных данных, которые бы указывали на то, что он может улучшить клинические результаты , — сказал директор NIAID и член Целевой группы США по коронавирусу доктор Энтони Фаучи. — Рандомизированное, плацебо-контролируемое испытание является золотым стандартом для определения, может ли экспериментальное лечение принести пользу».
Участники исследования должны иметь лабораторно подтвержденную инфекцию SARS-CoV-2 и доказательства поражения легких, включая хрипы в легких с потребностью в дополнительном кислороде, или аномальные результаты рентгенографии грудной клетки, или состояние, требующее искусственной вентиляции легких. Лица с подтвержденной инфекцией, у которых заболевание протекает бессимптомно или с легкими симптомами, не будут включены в исследование. В соответствии со стандартными протоколами КИ пациенты должны предоставить информированное согласие на участие.
Все потенциальные участники пройдут общее медицинское обследование; тех, кого допустят к участию, распределят случайным образом в группу лечения либо в группу плацебо. Исследование является двойным слепым, то есть медработники и участники не будут знать, кто получает ремдесивир, кто плацебо. Участники группы лечения получат 200 мг ремдесивира внутривенно в первый день исследования и по 100 мг в течение всего времени госпитализации, до 10 дней. Группа плацебо получит равные объемы неактивного раствора.
Участникам будут регулярно измерять температуру, давление, фиксировать использование дополнительного кислорода; также они будут сдавать образцы крови, мазки из носа и горла примерно каждые два дня для анализа на SARS-CoV-2. Результаты в группах ремдесивира и плацебо сравнят на 15-й день, оценивая по семибалльной шкале от полного выздоровления до смерти.
Независимый совет по мониторингу данных и безопасности (DSMB) будет следить за исследованием и может рекомендовать прекратить его, как только появятся четкие и существенные доказательства различия в эффективности препарата и плацебо. Исследование возглавляет Андре Калил, доктор медицины, профессор внутренних болезней в UNMC.
Источник
NIH clinical trial of remdesivir to treat COVID-19 begins. // National Institutes of Health, February 25, 2020


 Меню
Меню





 Все темы
Все темы




 0
0








